As vibrações moleculares podem ser estudadas com o modelo do oscilador harmônico quântico. A energia é dada por:
\begin{equação}\label{oscilador de energia} E_v=\esquerda(v+\frac{1}{2}\direita)h\nu \end{equação}
Os diferentes níveis de energia são dados pelo número quântico v, que assume valores 0.1.2.3.4.....
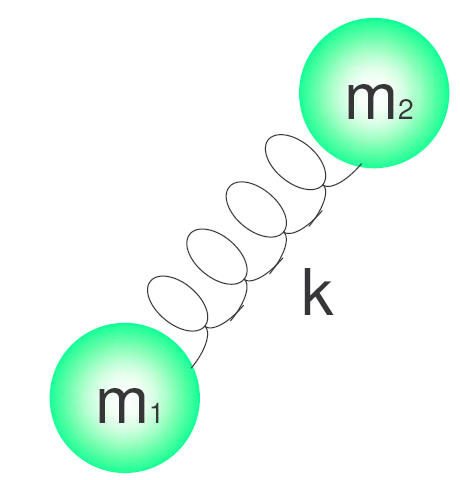
h é a constante de Planck e $\nu$ é a frequência do oscilador que é dada pela expressão:\begin{equation} \nu=\frac{1}{2\pi}\sqrt{\frac{k}{\ mu}} \end{equação} Onde k é a constante de força da mola e $\mu$ é a massa reduzida do sistema. $\mu=\frac{m_1m_2}{m_1+m_2}$.
A divisão da frequência pela velocidade da luz dá o número de ondas $\bar{\nu}$ \begin{equação}\label{número de ondas} \bar{\nu}=\frac{1}{2\pi c}\sqrt{\frac{k}{\mu}} \end{equação} O estudo da equação (\ref{número-ondas}) permitirá prever em que número de ondas as ligações de uma molécula absorvem radiação infravermelha. Esta equação só é aplicável a vibrações de tensão.
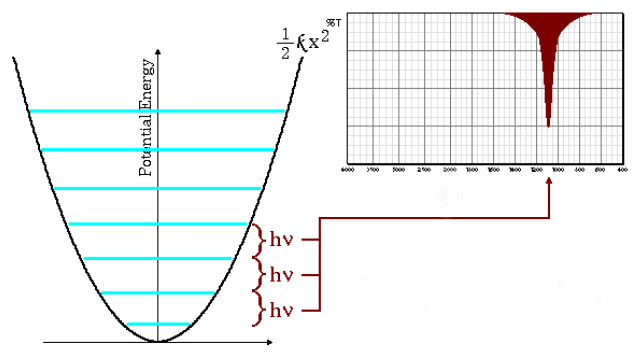
Frequências de alta absorção
A equação (\ref{número de onda}) indica que pequenas massas reduzidas (átomos de baixa massa) e altas constantes de força (ligações fortes) levam a altas frequências. Nessas condições, as bandas de absorção surgem em números de onda altos.
Como pode ser visto no gráfico, altas frequências dão origem a um maior espaçamento entre os níveis de energia.
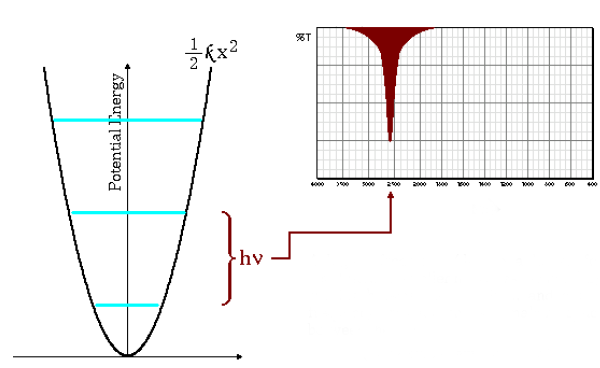
Frequências de baixa absorção
A equação (\ref{número de onda}) indica que grandes massas pequenas e pequenas constantes de força (ligações fracas) levam a baixas frequências. Nessas condições, as bandas de absorção aparecem em números de onda baixos.
Como pode ser visto no gráfico, as baixas frequências dão origem a um menor espaçamento entre os níveis de energia.