THEORIE DER ENOLE UND ENOLATEN
- Details
- Germán Fernández
- THEORIE DER ENOLE UND ENOLATEN
- Zugriffe: 39019
- Details
- Germán Fernández
- THEORIE DER ENOLE UND ENOLATEN
- Zugriffe: 32794
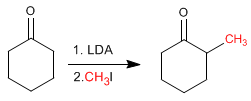
Cyclohexanon wird durch Behandlung mit LDA, gefolgt von Methyliodid, in 2-Methylcyclohexanon umgewandelt.
- Details
- Germán Fernández
- THEORIE DER ENOLE UND ENOLATEN
- Zugriffe: 21252
- Details
- Germán Fernández
- THEORIE DER ENOLE UND ENOLATEN
- Zugriffe: 56343
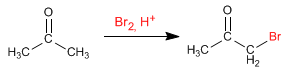
Halogenierung von Propanon in saurem Medium:
- Details
- Germán Fernández
- THEORIE DER ENOLE UND ENOLATEN
- Zugriffe: 104815
Methylketone [1] reagieren mit Halogenen in basischen Medien unter Bildung von Carboxylaten [2] und Haloformen [ 3] .
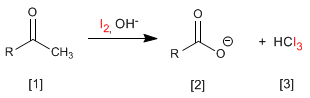
- Details
- Germán Fernández
- THEORIE DER ENOLE UND ENOLATEN
- Zugriffe: 111005
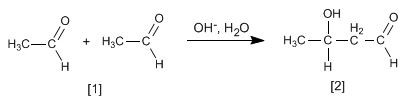
Das gebildete Aldol dehydratisiert im basischen Medium durch Erhitzen unter Bildung einer a , b- ungesättigten Gruppe.
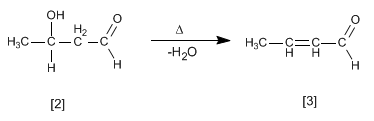
- Details
- Germán Fernández
- THEORIE DER ENOLE UND ENOLATEN
- Zugriffe: 50455
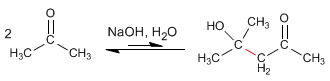
- Details
- Germán Fernández
- THEORIE DER ENOLE UND ENOLATEN
- Zugriffe: 48322
So kondensiert 2,6-Heptandion mit Methoxid in Methanol, um 3-Methylcyclohex-2-enon zu bilden.
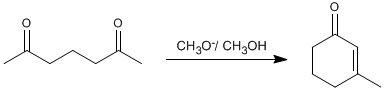
- Details
- Germán Fernández
- THEORIE DER ENOLE UND ENOLATEN
- Zugriffe: 77351
Die Reaktion zwischen zwei verschiedenen Carbonylen wird als gekreuztes oder gemischtes Aldol bezeichnet. Diese Reaktion hat nur in zwei Fällen einen synthetischen Nutzen:
1. Nur eines der Carbonyle kann Enolate bilden.
2. Eines der Carbonyle ist viel reaktiver als das andere.
In allen anderen Situationen erzeugt das gemischte Aldol Mischungen aus vier Produkten. Sehen wir uns als Beispiel die Kondensation von Ethanal und Propanal an. 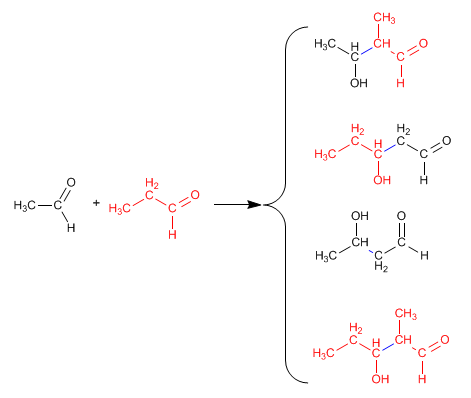
- Details
- Germán Fernández
- THEORIE DER ENOLE UND ENOLATEN
- Zugriffe: 66579
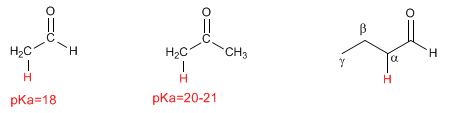
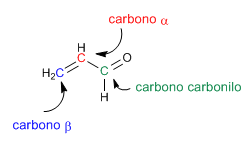 Die a,b -ungesättigten Carbonyle sind organische Verbindungen, die eine Doppelbindung zwischen den a,b- Positionen eines Aldehyds oder Ketons aufweisen.
Die a,b -ungesättigten Carbonyle sind organische Verbindungen, die eine Doppelbindung zwischen den a,b- Positionen eines Aldehyds oder Ketons aufweisen.
Propenal oder Acrolein ist ein a,b -ungesättigtes Carbonyl. Seine zwei konjugierten Doppelbindungen verleihen ihm eine besondere Reaktivität.
Weiterlesen: Synthese von alpha, beta-ungesättigten Carbonylen
- Details
- Germán Fernández
- THEORIE DER ENOLE UND ENOLATEN
- Zugriffe: 49767
Die a,b -ungesättigten Verbindungen sind Verbindungen mit zwei elektrophilen Positionen: dem Carbonylkohlenstoff und dem b- Kohlenstoff.
Ergänzungen 1,2. Organometallische Lithiumverbindungen greifen den Carbonylkohlenstoff an, was zu 1,2-Additionen führt.
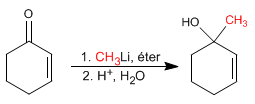
{nota} Die Organometalle von Lithium und Magnesium greifen den Carbonylkohlenstoff der a,b- ungesättigten Verbindungen an{/nota}
Weiterlesen: Reaktivität von alpha, beta-ungesättigten Carbonylen
- Details
- Germán Fernández
- THEORIE DER ENOLE UND ENOLATEN
- Zugriffe: 52487
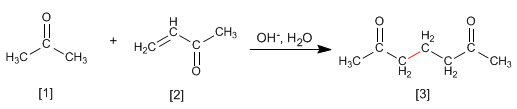
Propanon reagiert mit a,b -ungesättigt zu 1,5-Dicarbonyl
Weiterlesen: Hinzufügung von Michael und Annullierung von Robinson