Les différentes dispositions spatiales que peut adopter une molécule et qui s'interconvertissent à température ambiante par rotation sont appelées conformations.
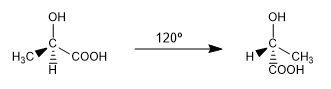
Ce sont deux des conformations infinies qui peuvent être tirées de l'ac. 2-hydroxypropanoïque. A température ambiante, la molécule est en rotation continue à travers toutes les conformations possibles.
Examinons maintenant les deux conformations les plus caractéristiques de l'éthane, les conformations alternées et éclipsées.
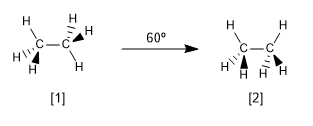
[1 ] Conformation alternative de l'éthane
[2] Conformation éclipsée de l'éthane
Certaines réactions dépendent fortement de la conformation dans laquelle la molécule est disposée. Ainsi, l'élimination de E2 nécessite que les molécules adoptent l'arrangement ANTI et sa vitesse dépend de la concentration de molécules qui sont dans cette conformation.
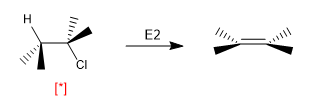
[*] Disposition "ANTI" H-Cl
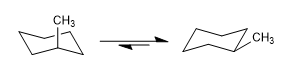
Les cyclohexanes ont également deux conformations de chaise qui s'interconvertissent à température ambiante. La conformation qui laisse le plus de groupes en position équatoriale est généralement celle qui présente la plus grande stabilité.
Un autre exemple d'équilibre conformationnel est présenté par les biphényles. Lorsque les deux anneaux sont disposés dans le même plan, ils forment un système aromatique, tourner à 90º rompt la conjugaison entre eux et rend la molécule plus instable.
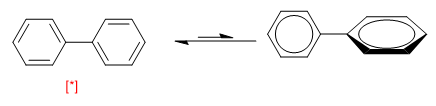
[*] Une conformation plus stable
Cependant, la présence de groupes volumineux dans les positions ortho par rapport aux deux anneaux produit des répulsions qui forcent la molécule à tourner, dans ce cas la conformation avec les anneaux perpendiculaires est plus stable.
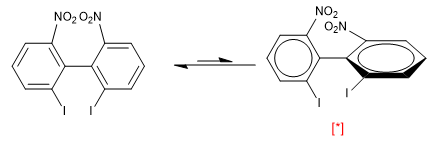
[*] Une conformation plus stable
A température ambiante, seule la conformation la plus stable est observée (côté droit). La répulsion entre les deux nitros et les deux iodes est si importante que la rotation du biphényle a une énergie d'activation de 19 Kca/mol.
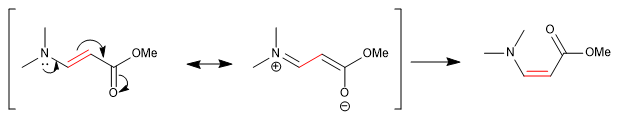
Certains liens, bien qu'apparemment simples, ne permettent pas aux groupes de tourner librement autour d'eux. Les méthyles DMF donnent deux singulets, à des déplacements chimiques différents, dans le spectre RMN car la liaison CN a un fort caractère de double liaison et limite la rotation des groupes.
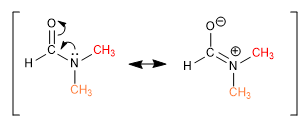
D'autres liaisons, apparemment doubles, permettent la rotation grâce à l'apport d'une structure résonnante dans laquelle elles se comportent comme des liaisons simples.