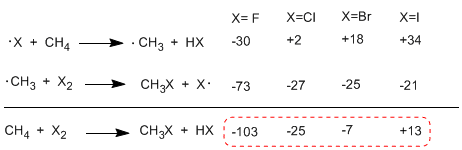En comparant les enthalpies des étapes de propagation des différents halogènes, des différences importantes dans les chaleurs échangées sont observées. Dans le cas du fluor, les deux étapes sont exothermiques (même le prélèvement d'hydrogène) avec un bilan énergétique global de -103 Kcal/mol. Les énergies d'activation des états de transition dans cette réaction sont très faibles, ce qui en fait l'halogène le plus réactif.
À l'autre extrême de la réactivité se trouve l'iode, dont la réaction est endothermique et n'a pas lieu.
Ordre de réactivité F 2>Cl 2> Br 2> I 2
Le tableau suivant montre la chaleur échangée dans les étapes de propagation pour l'halogénation du méthane.
La réaction est fortement exothermique dans le cas du fluor (halogène plus réactif) alors que dans le cas de l'iode elle est endothermique à 13 Kcal/mol.