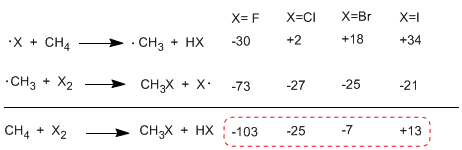TEORI REAKSI HALOGENASI
- Detail
- Germán Fernández
- TEORI REAKSI HALOGENASI
- Dilihat: 1851
Alkana bereaksi dengan halogen melalui mekanisme radikal. Reaksi tersebut mengandaikan substitusi satu atau beberapa hidrogen alkana oleh halogen.
Mekanisme halogenasi radikal
Mekanisme halogenasi radikal terdiri dari tiga tahap: inisiasi, propagasi, dan terminasi. Dalam inisiasi, molekul halogen pecah secara homolitik, menghasilkan radikal. Pada tahap propagasi, terjadi substitusi hidrogen alkana oleh halogen. Ketika reaktan habis, radikal di tengah bersatu satu sama lain, menghasilkan tahap terminasi.
Reaktivitas halogen
Tahap pertama propagasi menentukan laju reaksi. Untuk fluor, tahap ini memiliki energi aktivasi yang rendah, yang menjadikan fluor sebagai halogen yang paling reaktif. Dalam kasus yodium, energi aktivasi sangat tinggi dan reaksi tidak berlangsung. Urutan reaktivitas dalam reaksi radikal: $F_2>Cl_2>Br_2>I_2$. Singkatnya, yodium tidak reaktif dalam halogenasi radikal dan fluor bereaksi hebat.
polihalogenasi
Reaksi halogenasi sulit dihentikan, karena produk terhalogenasi lebih reaktif daripada alkana awal. Untuk menghindari masalah ini, yang disebut polihalogenasi, kelebihan alkana digunakan.
stabilitas radikal
Mekanisme reaksi ini terjadi dengan pembentukan zat antara yang disebut radikal yang stabilitasnya bergantung pada jumlah substituen yang mengelilingi karbon yang mengandung elektron bebas. Radikal yang terbentuk pada langkah propagasi distabilkan oleh hiperkonjugasi. Urutan stabilitas radikal diberikan oleh: tersier> sekunder> primer.
- Detail
- Germán Fernández
- TEORI REAKSI HALOGENASI
- Dilihat: 49495
MEKANISME REAKSI
Halogenasi radikal berlangsung dalam tiga tahap yang disebut: inisiasi, propagasi, dan terminasi:
tahap inisiasi
Pada langkah pertama reaksi, pembelahan homolitik dari ikatan Cl-Cl terjadi. Ini dicapai dengan panas atau dengan menyerap cahaya.
![]()
- Detail
- Germán Fernández
- TEORI REAKSI HALOGENASI
- Dilihat: 24957
Kita akan menggambarkan dalam diagram energi dua tahap propagasi halogenasi metana.
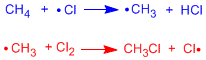
Tahap pertama perambatan adalah yang membatasi kecepatan proses, ia memiliki energi aktivasi tertinggi. Diagram menunjukkan reaktan, produk, zat antara, dan keadaan transisi untuk halogenasi radikal metana.
- Detail
- Germán Fernández
- TEORI REAKSI HALOGENASI
- Dilihat: 20968
Ketika membandingkan entalpi tahap propagasi dari halogen yang berbeda, perbedaan penting dalam panas yang dipertukarkan diamati. Dalam kasus fluorin, kedua langkah bersifat eksotermik (bahkan abstraksi hidrogen) dengan keseimbangan energi global -103 Kkal/mol. Energi aktivasi keadaan transisi dalam reaksi ini sangat rendah, membuatnya menjadi halogen yang paling reaktif.
Di sisi ekstrim lain dari reaktivitas adalah yodium, yang reaksinya endotermik dan tidak berlangsung.
Urutan kereaktifan F 2>Cl 2> Br 2> I 2
Tabel berikut menunjukkan pertukaran panas pada tahap propagasi untuk halogenasi metana.
Reaksinya sangat eksotermik dalam kasus fluor (halogen lebih reaktif) sedangkan dalam kasus yodium, reaksinya endotermik pada 13 Kkal/mol.
- Detail
- Germán Fernández
- TEORI REAKSI HALOGENASI
- Dilihat: 20596
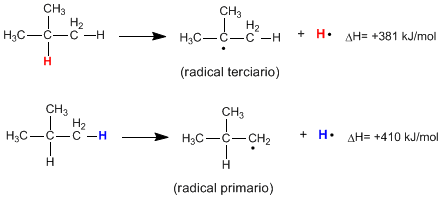
Pemutusan homolitik ikatan CH suatu alkana menghasilkan radikal alkil dan atom hidrogen bebas. Energi yang diperlukan untuk terjadinya kerusakan ini disebut energi disosiasi dan lebih rendah semakin stabil radikal yang terbentuk.
Seperti dapat dilihat dari reaksi berikut, energi yang dibutuhkan untuk memutuskan ikatan CH primer jauh lebih tinggi daripada yang dibutuhkan untuk memutuskan ikatan CH tersier.
- Detail
- Germán Fernández
- TEORI REAKSI HALOGENASI
- Dilihat: 25291
Dalam propana ada dua jenis hidrogen non-ekuivalen yang dapat digantikan oleh halogen, memperoleh 1-kloropropana dan 2-kloropropana.
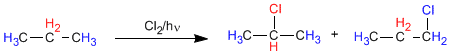
Proporsi di mana produk ini diperoleh bergantung pada dua faktor: jumlah hidrogen yang digantikan oleh halogen dan kestabilan radikal yang terbentuk.