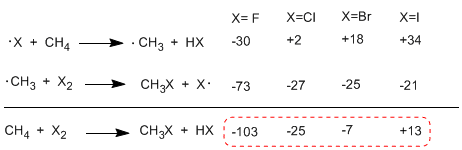ТЕОРИЯ РЕАКЦИИ ГАЛОГЕНИРОВАНИЯ
- Информация о материале
- Germán Fernández
- ТЕОРИЯ РЕАКЦИИ ГАЛОГЕНИРОВАНИЯ
- Просмотров: 1699
Алканы реагируют с галогенами по радикальным механизмам. Указанная реакция предполагает замещение одного или нескольких атомов водорода алкана галогенами.
Механизм радикального галогенирования
Механизм радикального галогенирования состоит из трех стадий: инициации, распространения и обрыва. При инициировании молекула галогена гомолитически разрывается с образованием радикалов. На стадии размножения происходит замещение атомов водорода алкана галогенами. Когда реагенты исчерпаны, радикалы в середине объединяются друг с другом, образуя стадию обрыва.
Галогенная реакционная способность
Первая стадия распространения определяет скорость реакции. Для фтора эта стадия имеет низкую энергию активации, что делает фтор наиболее реакционноспособным галогеном. В случае йода энергия активации очень велика и реакция не идет. Порядок реакционной способности в радикальных реакциях: $F_2>Cl_2>Br_2>I_2$. Короче говоря, йод не реагирует при радикальном галогенировании, а фтор реагирует бурно.
полигалогенаты
Реакцию галогенирования трудно остановить, так как галогенированный продукт более реакционноспособен, чем исходный алкан. Чтобы избежать этой проблемы, называемой полигалогенированием, используется избыток алкана.
радикальная стабильность
Механизм этих реакций происходит с образованием промежуточного соединения, называемого радикалом, стабильность которого зависит от числа заместителей, окружающих углерод, содержащий неподеленный электрон. Радикалы, образующиеся на этапе распространения, стабилизируются за счет гиперконъюгации. Порядок стабильности радикалов определяется следующим образом: третичный> вторичный> первичный.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ РЕАКЦИИ ГАЛОГЕНИРОВАНИЯ
- Просмотров: 49100
МЕХАНИЗМ РЕАКЦИИ
Радикальное галогенирование протекает в три стадии, называемые: инициирование, распространение и прекращение:
стадия инициации
На первой стадии реакции происходит гомолитический разрыв связи Cl-Cl. Это достигается с помощью тепла или поглощения света.
![]()
- Информация о материале
- Germán Fernández
- ТЕОРИЯ РЕАКЦИИ ГАЛОГЕНИРОВАНИЯ
- Просмотров: 25210
Мы собираемся изобразить на энергетической диаграмме две стадии распространения галогенирования метана.
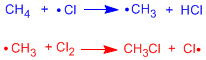
Первая стадия распространения ограничивает скорость процесса, имеет наибольшую энергию активации. На диаграмме представлены реагенты, продукты, промежуточные продукты и переходные состояния радикального галогенирования метана.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ РЕАКЦИИ ГАЛОГЕНИРОВАНИЯ
- Просмотров: 20850
При сравнении энтальпий стадий распространения различных галогенов наблюдаются важные различия в обмениваемых теплотах. В случае фтора обе стадии являются экзотермическими (даже выделение водорода) с глобальным энергетическим балансом -103 ккал/моль. Энергии активации переходных состояний в этой реакции очень низкие, что делает его наиболее реакционноспособным галогеном.
На другом полюсе реакционной способности находится йод, реакция которого эндотермическая и не протекает.
Порядок реакционной способности F 2>Cl 2> Br 2> I 2
В следующей таблице показан теплообмен на стадиях распространения галогенирования метана.
Реакция сильно экзотермична в случае фтора (галоген более реакционноспособен), тогда как в случае йода она эндотермична при 13 ккал/моль.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ РЕАКЦИИ ГАЛОГЕНИРОВАНИЯ
- Просмотров: 21000
Гомолитический разрыв связи CH алкана приводит к образованию алкильных радикалов и свободных атомов водорода. Энергия, необходимая для этого разрыва, называется энергией диссоциации, и она тем ниже, чем стабильнее образовавшийся радикал.
Как видно из следующих реакций, энергия, необходимая для разрыва первичной связи CH, намного выше, чем энергия, необходимая для разрыва третичной связи CH.
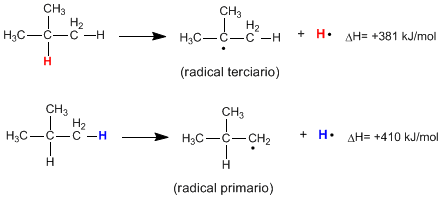
Подробнее: Радикальная стабильность в радикальных галогенированиях
- Информация о материале
- Germán Fernández
- ТЕОРИЯ РЕАКЦИИ ГАЛОГЕНИРОВАНИЯ
- Просмотров: 25515
В пропане есть два типа неэквивалентных водородов, которые можно заменить галогеном, получив 1-хлорпропан и 2-хлорпропан.
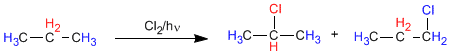
Соотношение, в котором получаются эти продукты, зависит от двух факторов: количества атомов водорода, подлежащих замещению галогеном, и стабильности образующегося радикала.