Dans le propane, il existe deux types d'hydrogènes non équivalents qui peuvent être remplacés par des halogènes, obtenant le 1-chloropropane et le 2-chloropropane.
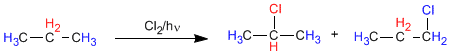
La proportion dans laquelle ces produits sont obtenus dépend de deux facteurs : le nombre d'hydrogènes à remplacer par de l'halogène et la stabilité du radical formé.
Nombre d'hydrogènes
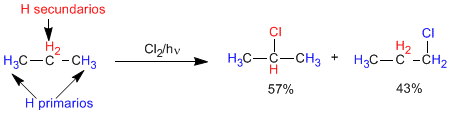
Puisque le propane a 6 hydrogènes primaires et 2 secondaires, le rapport des produits devrait être de 3 à 1.
stabilité radicale
Cependant, les liaisons CH secondaires sont plus faibles que les primaires et l'élimination d'un hydrogène secondaire par le radical chlore est plus rapide que celle d'un primaire (environ 4 fois plus rapide). Ces différences de vitesse de soustraction sont dues à la plus grande stabilité du radical secondaire par rapport au radical primaire. Ces données nous permettent de calculer la proportion dans laquelle les deux produits sont obtenus.
vitesses relatives
F(1 : 1,2 : 1,4), Cl(1 : 4 : 5), Br(1 : 250 : 6300). Le premier chiffre indique la vitesse à laquelle un hydrogène primaire est remplacé par l'halogène correspondant. La deuxième valeur nous indique la vitesse de substitution d'un hydrogène secondaire par un halogène. La troisième valeur s'applique aux hydrogènes tertiaires.
Sélectivité et réactivité
Plus l'halogène est réactif, moins il distingue les hydrogènes primaires, secondaires ou tertiaires. Le fluor halogéne les trois types d'hydrogène presque également et serait peu sélectif. Au contraire, le brome est très peu réactif et recherche les hydrogènes les plus faciles à éliminer (les tertiaires) et les remplace 6300 fois plus vite que les primaires. On dit de lui qu'il est très sélectif.
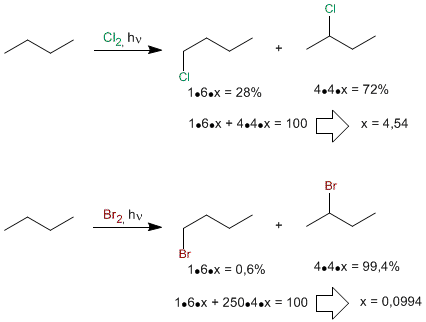
La faible réactivité du brome lui confère une grande sélectivité, halogénant très majoritairement la position secondaire par rapport à la primaire. Comme on peut le voir, le chlore est beaucoup moins sélectif.