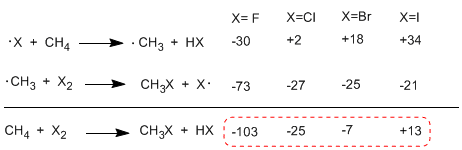THEORIE HALOGENIERUNGSREAKTIONEN
- Details
- Germán Fernández
- THEORIE HALOGENIERUNGSREAKTIONEN
- Zugriffe: 1634
Alkane reagieren mit Halogenen über radikalische Mechanismen. Diese Reaktion setzt die Substitution von einem oder mehreren Wasserstoffatomen des Alkans durch Halogene voraus.
Mechanismus der radikalischen Halogenierung
Der radikalische Halogenierungsmechanismus besteht aus drei Stufen: Initiierung, Ausbreitung und Beendigung. Bei der Initiierung bricht das Halogenmolekül homolytisch und erzeugt Radikale. In der Propagationsstufe erfolgt die Substitution von Wasserstoffen des Alkans durch Halogene. Wenn die Reaktanten erschöpft sind, verbinden sich die Radikale in der Mitte miteinander und erzeugen die Abbruchstufe.
Halogenreaktivität
Die erste Ausbreitungsstufe bestimmt die Geschwindigkeit der Reaktion. Für Fluor hat diese Stufe eine niedrige Aktivierungsenergie, was Fluor zum reaktivsten Halogen macht. Bei Jod ist die Aktivierungsenergie sehr hoch und die Reaktion findet nicht statt. Reaktivitätsreihenfolge bei Radikalreaktionen: $F_2>Cl_2>Br_2>I_2$. Kurz gesagt, Jod ist bei radikalischer Halogenierung unreaktiv und Fluor reagiert heftig.
Polyhalogenierungen
Die Halogenierungsreaktion ist schwer zu stoppen, da das halogenierte Produkt reaktiver ist als das Ausgangsalkan. Um dieses als Polyhalogenierungen bezeichnete Problem zu vermeiden, wird überschüssiges Alkan verwendet.
radikale Stabilität
Der Mechanismus dieser Reaktionen erfolgt mit der Bildung eines Zwischenprodukts, das als Radikal bezeichnet wird und dessen Stabilität von der Anzahl der Substituenten abhängt, die den Kohlenstoff umgeben, der das einsame Elektron enthält. Die im Propagationsschritt gebildeten Radikale werden durch Hyperkonjugation stabilisiert. Die Reihenfolge der Stabilität der Radikale ist gegeben durch: tertiär> sekundär> primär.
- Details
- Germán Fernández
- THEORIE HALOGENIERUNGSREAKTIONEN
- Zugriffe: 49213
Reaktionsmechanismus
Radikalhalogenierungen finden in drei Stufen statt, die als Initiierung, Ausbreitung und Beendigung bezeichnet werden:
Initiationsphase
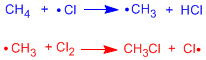
Im ersten Reaktionsschritt erfolgt die homolytische Spaltung der Cl-Cl-Bindung. Dies wird durch Wärme oder durch Absorption von Licht erreicht.
![]()
- Details
- Germán Fernández
- THEORIE HALOGENIERUNGSREAKTIONEN
- Zugriffe: 25425
Wir werden in einem Energiediagramm die zwei Ausbreitungsstufen der Halogenierung von Methan darstellen.
Die erste Ausbreitungsstufe ist diejenige, die die Geschwindigkeit des Prozesses begrenzt, sie hat die höchste Aktivierungsenergie. Das Diagramm zeigt Reaktanten, Produkte, Zwischenprodukte und Übergangszustände für die radikalische Halogenierung von Methan.
- Details
- Germán Fernández
- THEORIE HALOGENIERUNGSREAKTIONEN
- Zugriffe: 20548
Beim Vergleich der Enthalpien der Ausbreitungsstufen der verschiedenen Halogene werden wichtige Unterschiede in der ausgetauschten Wärme beobachtet. Im Fall von Fluor sind beide Schritte exotherm (sogar die Abstraktion von Wasserstoff) mit einer globalen Energiebilanz von -103 Kcal/mol. Die Aktivierungsenergien der Übergangszustände in dieser Reaktion sind sehr niedrig, was es zum reaktivsten Halogen macht.
Das andere Extrem der Reaktivität ist Jod, dessen Reaktion endotherm ist und nicht stattfindet.
Reaktivitätsreihenfolge F 2>Cl 2> Br 2> I 2
Die folgende Tabelle zeigt den Wärmeaustausch in den Ausbreitungsstufen für die Halogenierung von Methan.
Die Reaktion ist im Falle von Fluor (Halogen reaktiver) stark exotherm, während sie im Falle von Jod bei 13 Kcal/mol endotherm ist.
- Details
- Germán Fernández
- THEORIE HALOGENIERUNGSREAKTIONEN
- Zugriffe: 22500
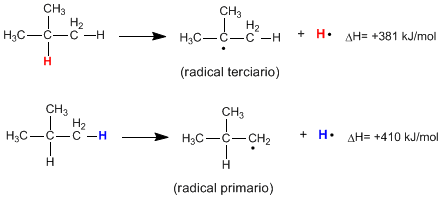
Beim homolytischen Brechen der CH-Bindung eines Alkans entstehen Alkylradikale und freie Wasserstoffatome. Die für diesen Bruch erforderliche Energie wird als Dissoziationsenergie bezeichnet und ist umso geringer, je stabiler das gebildete Radikal ist.
Wie aus den folgenden Reaktionen ersichtlich ist, ist die zum Aufbrechen einer primären CH-Bindung erforderliche Energie viel höher als die zum Aufbrechen einer tertiären CH-Bindung erforderliche Energie.
Weiterlesen: Radikalstabilität bei radikalischen Halogenierungen
- Details
- Germán Fernández
- THEORIE HALOGENIERUNGSREAKTIONEN
- Zugriffe: 25303
In Propan gibt es zwei Arten von nicht äquivalenten Wasserstoffen, die durch Halogen ersetzt werden können, wodurch 1-Chlorpropan und 2-Chlorpropan erhalten werden.
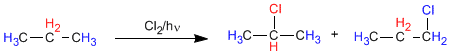
Der Anteil, in dem diese Produkte erhalten werden, hängt von zwei Faktoren ab: der Anzahl der durch Halogen zu ersetzenden Wasserstoffatome und der Stabilität des gebildeten Radikals.