Allylische Systeme können als Substrate in nukleophilen Substitutionsreaktionen fungieren. So erzeugt die Reaktion von 3-Chlor-1-buten mit Wasser zwei Allylalkohole.
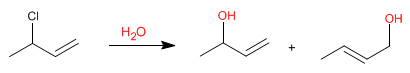
Da Wasser ein schlechtes Nucleophil ist, ist der Substitutionsmechanismus unimolekular (S N 1), mit der Besonderheit, dass die Abgangsgruppe (Chlor) an einer allylischen Position gefunden wird.
Wir beschreiben den Mechanismus unten:
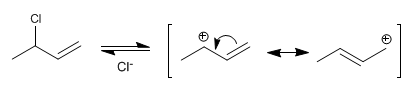
Stufe 1 . Bildung des allylischen Carbokations durch Verlust der Abgangsgruppe. Das Carbokation wird durch Resonanz stabilisiert, wobei das Hybrid durch zwei resonante Strukturen gebildet wird.
Stufe 2 . Nucleophiler Angriff von Wasser auf das gebildete Carbokation. Das Carbokation liegt in zwei Strukturen vor, die bei Angriff zwei unterschiedliche Produkte bilden. Die wichtigste Struktur ist diejenige, die die Ladung auf dem Sekundärkohlenstoff lokalisiert und daraus das Hauptprodukt erhält (niedrige Temperaturbedingungen und kurze Reaktionszeiten).
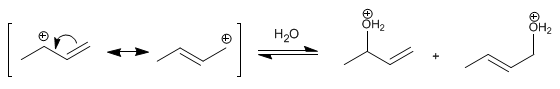
Stufe 3 . Deprotonierung Wasser verliert ein Proton und wird zu Alkohol.
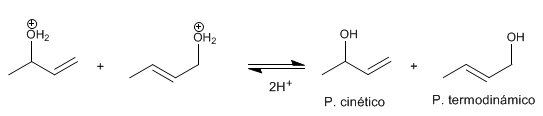
Das stabilste Produkt (am stärksten substituierte Doppelbindung) wird als thermodynamisch bezeichnet. Das am wenigsten stabile Produkt wird als kinetisch bezeichnet.