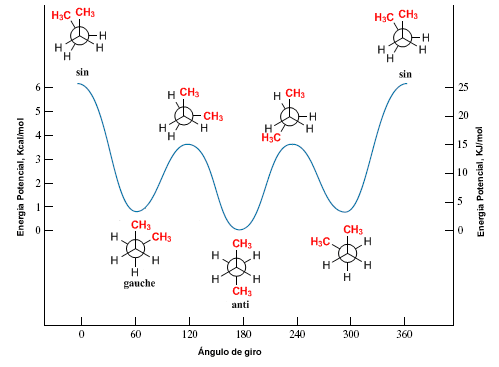
Betrachten wir die C2-C3-Bindung von Butan. Die 60º-Drehungen um diese Verbindung herum erzeugen die möglichen Konformationen von Butan. Es werden drei Konformationen von besonderer Bedeutung genannt; Butan ohne , Butan anti und Butan gauche , die wir in den folgenden Modellen darstellen.
Die "anti"-Konformation von Butan ist diejenige mit der niedrigsten Energie. Die Methyls befinden sich auf gegenüberliegenden Seiten, wodurch Abstoßungen minimiert werden. 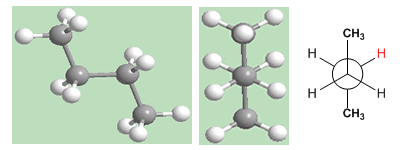
In der Gauche-Konformation führt die Nähe der Methylgruppen zu einer abstoßenden Wechselwirkung, die als Gauche-Wechselwirkung bezeichnet wird. Diese Abstoßung zwischen Methylen beträgt etwa 3,2 Kcal/Mol. 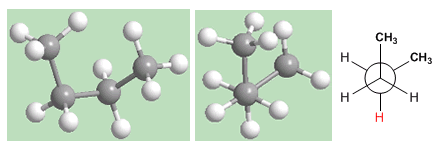
Die "syn"-Konformation ist diejenige mit der höchsten Energie. Die Methyls stehen einander gegenüber und die Abstoßungen (Eclipse-Wechselwirkungen) bewirken, dass diese Konformation eine um 25 KJ/mol höhere Energie hat als die Anti-Konformation. 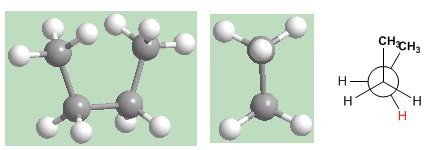
Wir zeichnen die Butankonformationen, die sich aus 60º-Drehungen ergeben.
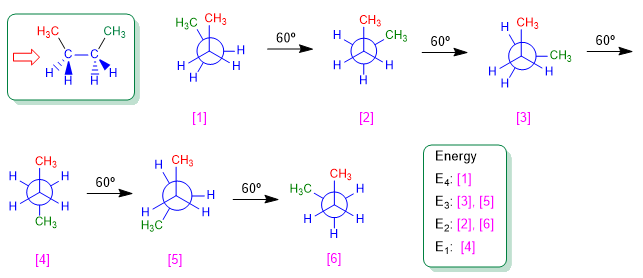
Das Diagramm der potentiellen Energie gegen den für Butan gedrehten Winkel hinterlässt uns: