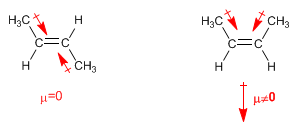Alkene haben Schmelz- und Siedepunkte in der Nähe der entsprechenden Alkane.
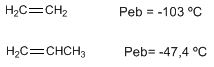
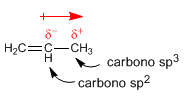
Dipolmoment in Alkenen. Beim Kohlenstoff $sp^2$ sind die Elektronen im s-Orbital näher am Kern und werden stark von ihm angezogen, so dass ein Kohlenstoff $sp^2$ die Tendenz hat, Elektronen an sich zu ziehen, was Dipolmomente erzeugt.
Bei „ trans “-Alkenen werden die Dipolmomente subtrahiert und heben sich sogar auf, falls beide Kohlenstoffe die gleichen Ketten haben. In cis-Alkenen addieren sich die Dipolmomente, was zu einem Gesamtdipolmoment ungleich Null führt (polares Molekül)