ALKAN-THEORIE
- Details
- Germán Fernández
- ALKAN-THEORIE
- Zugriffe: 2039
Was sind Alkane?
Alkane sind ausschließlich aus Kohlenstoff und Wasserstoff gebildete Verbindungen (Kohlenwasserstoffe), die nur einfache Kohlenstoff-Kohlenstoff-Bindungen enthalten.
Arten von Alkanen
Alkane werden in lineare, verzweigte, zyklische und polyzyklische Alkane eingeteilt.
Nomenklatur der Alkane
Alkane werden mit der Endung -ane benannt, dem Präfix, das die Anzahl der Kohlenstoffe im Molekül angibt (Methan, Ethan, Propan...)
Physikalische Eigenschaften von Alkanen
Die Schmelz- und Siedepunkte von Alkanen sind niedrig und steigen mit zunehmender Anzahl von Kohlenstoffen aufgrund von Wechselwirkungen zwischen Molekülen durch London-Kräfte. Lineare Alkane haben höhere Siedepunkte als ihre verzweigten Isomere.
Konformationsisomere
Alkane sind aufgrund des Spins um die CC-Bindung nicht starr. Die durch diese Rotationen erzeugten multiplen Formen werden Konformationen genannt.
Newman-Projektion
Die Energie der verschiedenen Konformationen ist in den Newman-Projektionen zu sehen. Daher ist im Fall von Ethan die verfinsterte Konformation aufgrund der Abstoßungen zwischen Wasserstoffatomen diejenige mit der höchsten Energie.
Potentialdiagramme
Die verschiedenen Konformationen von Alkanen können in einem Potentialenergiediagramm dargestellt werden, in dem wir sehen können, welche Konformation stabiler ist (minimale Energie) und welche Energie benötigt wird, um von einer Konformation in eine andere überzugehen.
Verbrennung von Alkanen
Aufgrund ihrer geringen Reaktivität werden Alkane auch als Paraffine bezeichnet. Die wichtigsten Reaktionen dieser Verbindungsgruppe sind radikalische Halogenierungen und Verbrennungen. Verbrennung ist die Kombination von Kohlenwasserstoff mit Sauerstoff, um Kohlendioxid und Wasser zu bilden.
- Details
- Germán Fernández
- ALKAN-THEORIE
- Zugriffe: 242260
Kohlenwasserstoffe sind Verbindungen, die nur Kohlenstoff und Wasserstoff enthalten. Sie werden in zwei Klassen eingeteilt: aliphatische und aromatische Kohlenwasserstoffe.
Aliphatische Kohlenwasserstoffe umfassen drei Klassen von Verbindungen: Alkane, Alkene und Alkine. Alkane sind Kohlenwasserstoffe, die nur Kohlenstoff-Kohlenstoff-Einfachbindungen enthalten, Alkene enthalten Kohlenstoff-Kohlenstoff-Doppelbindungen und Alkine sind Kohlenwasserstoffe, die eine Dreifachbindung enthalten. 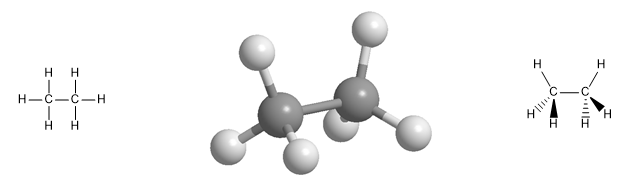
Molekulares Modell des Ethan-Moleküls. Ethan hat eine tetraedrische Geometrie, mit Kohlenstoff in der Mitte des Tetraeders und Wasserstoffatomen, die zu seinen Ecken hin ausgerichtet sind. Beachten Sie die räumliche Darstellung mit Keilen und gestrichelten Linien .
- Details
- Germán Fernández
- ALKAN-THEORIE
- Zugriffe: 181123
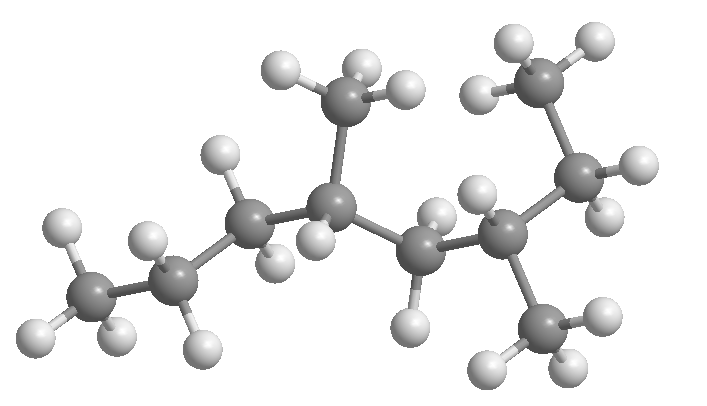
Alkane sind Verbindungen aus Kohlenstoff und Wasserstoff, die nur Kohlenstoff-Kohlenstoff-Einfachbindungen enthalten. Sie entsprechen der allgemeinen Formel C n H 2n+2 , wobei n die Anzahl der Kohlenstoffatome im Molekül ist.
Alkane, bei denen die Kohlenstoffe durchgehend (ohne Verzweigungen) verknüpft sind, werden als geradkettige Alkane bezeichnet.
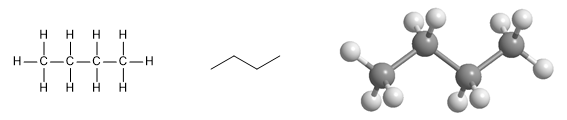
Butan-Molekül. Die erste Zeichnung zeigt die Vereinigungsform der Atome, die zweite die Zick-Zack-Form des Moleküls und schließlich sein Molekülmodell, in dem die räumliche Anordnung der Atome beobachtet wird.
- Details
- Germán Fernández
- ALKAN-THEORIE
- Zugriffe: 366522
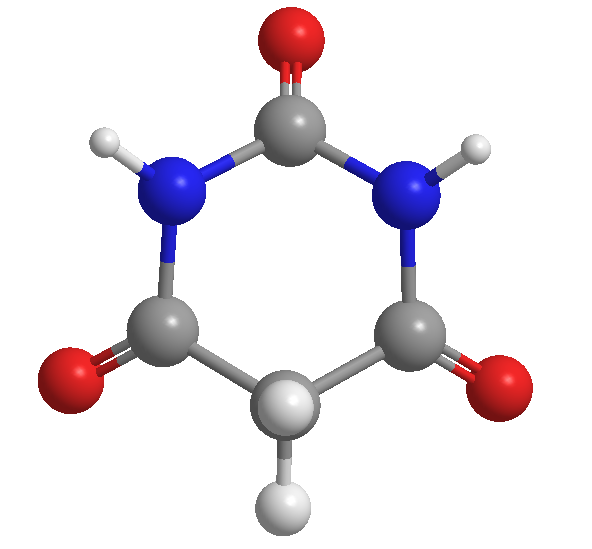
Barbitursäure, entdeckt von Adolf von Baeyer, 1864
In den Anfängen der Chemie wurden organische Verbindungen von ihren Entdeckern benannt. Harnstoff hat seinen Namen von der Isolierung aus Urin.
Barbitursäure wurde 1864 vom deutschen Chemiker Adolf von Baeyer entdeckt. Es wird spekuliert, dass er ihr diesen Namen zu Ehren einer Freundin namens Barbara gab.
Die chemische Wissenschaft machte Fortschritte, und die große Zahl entdeckter organischer Verbindungen machte es unabdingbar, eine systematische Nomenklatur zu verwenden.

[1] Isobutan (allgemeiner Name); Methylpropan (IUPAC-Bezeichnung)
[2] Isopentan (allgemeiner Name); Methylbutan (IUPAC-Bezeichnung)
Im Nomenklatursystem der IUPAC besteht ein Name aus drei Teilen: Präfixen, Hauptnamen und Suffixen; Die Präfixe geben die Substituenten des Moleküls an; das Suffix gibt die funktionelle Gruppe des Moleküls an; und der Hauptteil die Anzahl der Kohlenstoffe, die es hat.
Alkane können in sieben Schritten benannt werden:
Regel 1.- Bestimmen Sie die Anzahl der Kohlenstoffe der längsten Kette, die als Hauptkette des Alkans bezeichnet wird. Beachten Sie in den Abbildungen, dass es sich nicht immer um die horizontale Kette handelt.
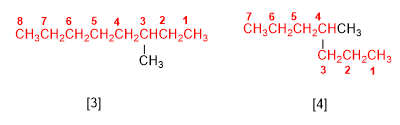
[3] 3-Methyloctan
[4] 4-Methylheptan
- Details
- Germán Fernández
- ALKAN-THEORIE
- Zugriffe: 65524
Regel 1. Der Name einer bicyclischen Verbindung besteht aus dem Wort Bicyclo, gefolgt von einer Klammer, die die Anzahl der Kohlenstoffe in jeder der drei Ketten angibt, die von den Brückenkopf-Kohlenstoffen ausgehen. Der Name endet mit dem des Alkans mit der gleichen Anzahl an Kohlenstoffatomen.

[1] Bicyclo[2.2.1]heptan
[2] Bicyclo[3.2.1]octan
[xxx] Die Brückenkopf-Kohlenstoffe der bicyclischen Verbindung sind mit einem blauen Punkt gezeichnet. Die Anzahl der Kohlenstoffe in jeder dieser Ketten (rot nummeriert) ist in Klammern angegeben, ohne die Brückenkopf-Kohlenstoffe mitzuzählen. Beachten Sie, dass die Zahlen von der höchsten zur niedrigsten geordnet und durch Punkte (nicht Kommas) getrennt sind.
Der Name der bicyclischen Verbindung endet mit dem des Alkans mit der gleichen Anzahl an Kohlenstoffatomen.
Weiterlesen: Nomenklatur für bicyclische Verbindungen – IUPAC-Regeln
- Details
- Germán Fernández
- ALKAN-THEORIE
- Zugriffe: 196329
Methan (CH 4 ), Ethan (C 2 H 6 ) und Propan (C 3 H 8 ) sind Alkane mit nur einer möglichen Struktur. Es gibt jedoch zwei Alkane mit der Formel C 4 H 10 ; Butan und 2-Methylpropan. Diese Alkane mit der gleichen Formel, aber unterschiedlichen Strukturen werden als Isomere bezeichnet.

[1] Butan
[2] 2-Methylpropan
n-Butan und Isobutan haben die gleiche Formel, unterscheiden sich jedoch in der Art und Weise, wie ihre Atome verbunden sind - sie sind Strukturisomere. Aufgrund ihrer unterschiedlichen Struktur haben sie unterschiedliche Eigenschaften, so unterscheiden sie sich um etwa 20 ° C in ihrem Schmelzpunkt und etwa 10 ° C in ihrem Siedepunkt.
- Details
- Germán Fernández
- ALKAN-THEORIE
- Zugriffe: 275603
Alkane sind sp 3 -hybridisierte Verbindungen an allen Kohlenstoffen. Die vier Substituenten, die von jedem Kohlenstoff ausgehen, sind zu den Eckpunkten eines Tetraeders hin angeordnet.
Bindungsabstände und -winkel werden bei den folgenden Modellen angezeigt. 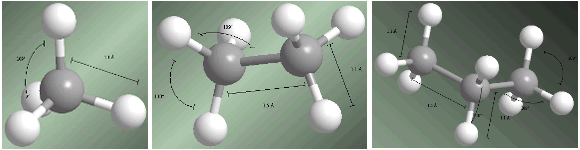
- Details
- Germán Fernández
- ALKAN-THEORIE
- Zugriffe: 145307
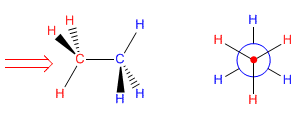 Die Newman-Projektion erhält man, indem man das Molekül entlang der CC-Achse betrachtet. Der vordere Kohlenstoff wird durch einen Punkt dargestellt, von dem aus die drei Bindungen beginnen, die ihn mit den Substituenten verbinden. Der hintere Kohlenstoff wird durch einen Kreis dargestellt, und die Bindungen, die diesen Kohlenstoff verlassen, werden aus diesem Kreis gezogen.
Die Newman-Projektion erhält man, indem man das Molekül entlang der CC-Achse betrachtet. Der vordere Kohlenstoff wird durch einen Punkt dargestellt, von dem aus die drei Bindungen beginnen, die ihn mit den Substituenten verbinden. Der hintere Kohlenstoff wird durch einen Kreis dargestellt, und die Bindungen, die diesen Kohlenstoff verlassen, werden aus diesem Kreis gezogen.
- Details
- Germán Fernández
- ALKAN-THEORIE
- Zugriffe: 117652
 Einfachbindungen zwischen Atomen haben Zylindersymmetrie und ermöglichen eine Rotation der an ihnen befestigten Atomgruppen. Die unterschiedlichen räumlichen Anordnungen, die die Atome durch Rotation um die Bindung einnehmen, nennt man Konformationen. Eine bestimmte Konformation von vielen möglichen wird als Konformer bezeichnet.
Einfachbindungen zwischen Atomen haben Zylindersymmetrie und ermöglichen eine Rotation der an ihnen befestigten Atomgruppen. Die unterschiedlichen räumlichen Anordnungen, die die Atome durch Rotation um die Bindung einnehmen, nennt man Konformationen. Eine bestimmte Konformation von vielen möglichen wird als Konformer bezeichnet.
- Details
- Germán Fernández
- ALKAN-THEORIE
- Zugriffe: 114150
Ethan ist das einfachste Alkan, das in verschiedenen Konformationen existieren kann. Von den unendlichen Konformationen, die durch Drehen der Kohlenstoff-Kohlenstoff-Bindung erhalten werden können, zeichnen sich die alternierenden und verfinsterten Konformationen durch ihre Bedeutung aus.
- Details
- Germán Fernández
- ALKAN-THEORIE
- Zugriffe: 89339
Betrachten wir die C2-C3-Bindung von Butan. Die 60º-Drehungen um diese Verbindung herum erzeugen die möglichen Konformationen von Butan. Es werden drei Konformationen von besonderer Bedeutung genannt; Butan ohne , Butan anti und Butan gauche , die wir in den folgenden Modellen darstellen.