Die folgenden Modelle zeigen die Struktur, Abstände und Bindungswinkel von Ethen. Jeder der Kohlenstoffe im Molekül ist $sp^2$ hybridisiert. Seine Geometrie ist flach, mit Bindungswinkeln nahe 120º.
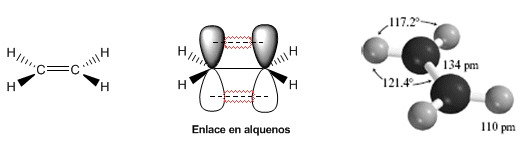
Die Doppelbindung wird durch eine $\sigma$-Bindung gebildet, die durch die Überlappung der $sp^2$-Hybridorbitale entsteht, und eine $\pi$-Bindung, die durch die Überlappung nicht hybridisierter p-Orbitale (reine p-Orbitale) entsteht ).
Die Doppelbindung ist stärker und kürzer als die Einfachbindung. Die Energie der Doppelbindung in Ethen beträgt 605 KJ/mol im Vergleich zu 368 KJ/mol für die Kohlenstoff-Kohlenstoff-Einfachbindung in Ethan.