In der Natur kommen Verbindungen mit Zyklen von fünf und sechs Gliedern sehr häufig vor. Allerdings treten die drei- und viergliedrigen Kreisläufe in Naturprodukten sehr selten auf.
Stabilität in Cycloalkanen
Diese experimentellen Tatsachen deuten auf die größere Stabilität der Zyklen von fünf oder sechs Mitgliedern im Vergleich zu denen von drei oder vier hin.
Im Jahr 1885 schlug der deutsche Chemiker Adolf von Baeyer vor, dass die Instabilität kleiner Zyklen auf die Spannung der Bindungswinkel zurückzuführen sei. Die sp 3 -Kohlenstoffe haben natürliche Bindungswinkel von 109,5°, in Cyclopropan betragen diese Winkel 60°, was einer Abweichung von 49,5° entspricht. Diese Auslenkung führt zu Stress, der das Molekül instabil macht.
Cyclobutan ist stabiler, da seine Bindungswinkel 90º betragen und die Durchbiegung nur 19,5º beträgt. Baeyer wandte diese Argumentation auf die anderen Cycloalkane an und sagte voraus, dass Cyclopentan stabiler sein sollte als Cyclohexan.
Winkelspannung
Beachten Sie die Bindungswinkel der verschiedenen Cycloalkane:
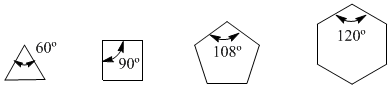
Da der natürliche Winkel eines sp 3 -Kohlenstoffs 109,5° beträgt, argumentierte von Baeyer, dass Cyclopentan das stabilste Cycloalkan sei. Wir wissen jedoch, dass Baeyer falsch lag, da das Cycloalkan mit der niedrigsten Energie (das stabilste) Cyclohexan ist. Bayers Fehler liegt in der Annahme, dass Cycloalkane planar sind und dass die einzige Art von Dehnung, die sie aufweisen, auf Bindungswinkel zurückzuführen ist.
Ring-Stress-Typen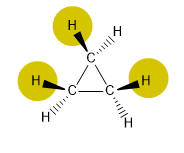
Es gibt drei Arten von Stress, die zyklische Verbindungen destabilisieren:
1.- Bindungswinkelspannung aufgrund von Winkeln, die von 109,5º abweichen.2.- Verdunklungsspannung aufgrund nahegelegener Atome oder Atomgruppen, die Abstoßungen erleiden (sterische Spannung).
Cyclopropan stellt aufgrund der niedrigen Bindungswinkel und der Wechselwirkungen zwischen Wasserstoffatomen (Eklipsationen) eine sehr wichtige Spannung dar.