ETHER-THEORIE
- Details
- Germán Fernández
- ETHER-THEORIE
- Zugriffe: 99249
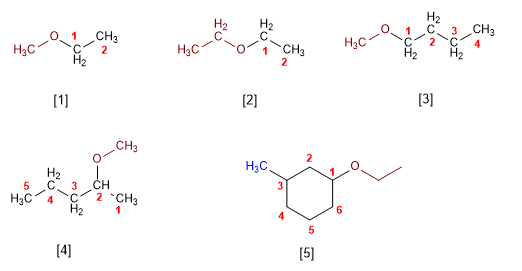
Regel 1. Ether können als Alkoxyderivate von Alkanen bezeichnet werden (substitutive IUPAC-Nomenklatur). Die längste Kette wird als Hauptkette genommen und das Alkoholat wird als Substituent genannt.
- Details
- Germán Fernández
- ETHER-THEORIE
- Zugriffe: 71715
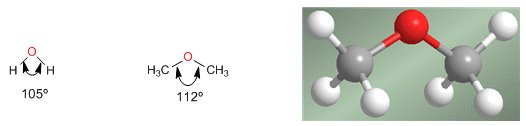
Ether sind Moleküle mit ähnlicher Struktur wie Wasser und Alkohole. Der Winkel zwischen den C- O -C-Bindungen ist aufgrund der sterischen Abstoßung zwischen voluminösen Gruppen größer als in Wasser.
- Details
- Germán Fernández
- ETHER-THEORIE
- Zugriffe: 176000
Ether haben niedrigere Siedepunkte als Alkohole, obwohl ihre Löslichkeit in Wasser ähnlich ist. Aufgrund ihrer hohen Stabilität in basischen Medien werden sie in zahlreichen Reaktionen als inerte Lösungsmittel eingesetzt.
- Details
- Germán Fernández
- ETHER-THEORIE
- Zugriffe: 101318
Weiterlesen: Synthese von Ethern durch Kondensation von Alkoholen
- Details
- Germán Fernández
- ETHER-THEORIE
- Zugriffe: 106822
Die Reaktion zwischen einem primären Halogenalkan und einem Alkoholat (oder Alkohol in einem basischen Medium) ist die wichtigste Methode zur Herstellung von Ethern. Diese Reaktion ist als Williamson-Synthese bekannt.
- Details
- Germán Fernández
- ETHER-THEORIE
- Zugriffe: 3026
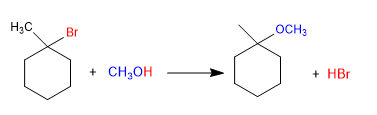
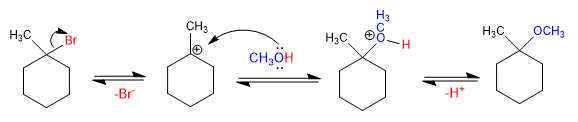
Ether können durch Umsetzung von Halogenalkanen mit Alkoholen nach dem S N 1-Mechanismus erhalten werden, wobei das Halogenalkan sekundär oder tertiär sein muss, um stabile Carbokationen zu bilden.
Mechanismus:
- Details
- Germán Fernández
- ETHER-THEORIE
- Zugriffe: 3423
Alkohole können geschützt werden, indem man sie in Ether umwandelt. Dieses Verfahren wird durchgeführt, indem der zu schützende Alkohol mit tert.-Butanol in einem schwefelsauren Medium umgesetzt wird. Die Entschützung findet in einem wässrigen sauren Medium statt. Sehen wir uns ein Beispiel an:
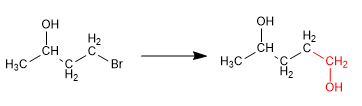
Bei dieser Synthese ist es notwendig, eine Kohlenstoff-Kohlenstoff-Bindung unter Verwendung von metallorganischen Reagenzien zu bilden, die mit Alkohol nicht kompatibel sind. Daher muss der Alkohol vorher geschützt werden, um die Zersetzung des Organometalls zu vermeiden.
- Details
- Germán Fernández
- ETHER-THEORIE
- Zugriffe: 7541
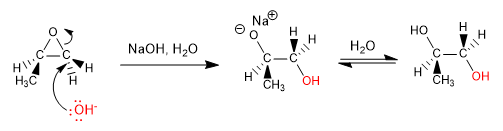
Epoxide (Oxacyclopropane) sind dreigliedrige cyclische Ether. Sein Hauptmerkmal ist die Spannung des Rings, die seine Öffnung sowohl in basischen als auch in sauren Medien begünstigt.
Öffnung in basischen Medien: Epoxide öffnen sich durch nukleophilen Angriff auf den am wenigsten substituierten Kohlenstoff (Öffnung wird durch sterische Hinderungen bestimmt)