Amine haben niedrigere Schmelz- und Siedepunkte als Alkohole. So siedet Ethylamin bei 17 °C, während der Siedepunkt von Ethanol bei 78 °C liegt.
CH 3 CH 2 OH P.b. = 78ºC
CH 3 CH 2 NH 2 P. eb. = 17ºC
Die im Vergleich zu Sauerstoff niedrigere Elektronegativität von Stickstoff macht die von Aminen gebildeten Wasserstoffbrückenbindungen schwächer als die von Alkoholen.
Es wird auch beobachtet, dass primäre Amine höhere Siedepunkte als sekundäre und diese wiederum höhere als tertiäre haben.
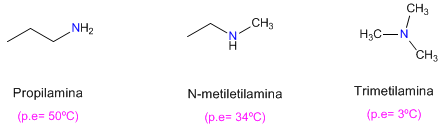
Das tertiäre Amin kann keine Wasserstoffbrückenbindungen bilden (es fehlt Wasserstoff am Stickstoff), was seinen niedrigen Siedepunkt erklärt.
Im Fall des sekundären Amins behindern die sterischen Hinderungen aufgrund der den Stickstoff umgebenden Ketten die Wechselwirkungen zwischen Molekülen.
Amine mit weniger als sieben Kohlenstoffatomen sind wasserlöslich.