Wasser ist eine sehr schwache Säure mit unzureichender Protonenkonzentration, um die elektrophile Additionsreaktion zu starten. Damit die Reaktion stattfinden kann, muss dem Medium eine Säure (H 2 SO 4 ) zugesetzt werden.
Diese Reaktion ist auch als Hydratation von Alkenen bekannt und erzeugt Alkohole.
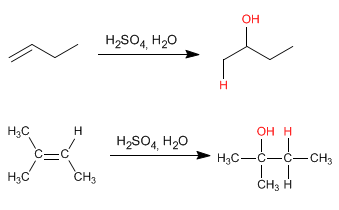
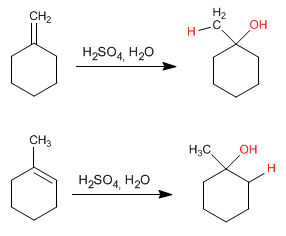
Diese Reaktion wird mit verdünnter Schwefelsäure 50 % Schwefel/H 2 O durchgeführt und erfordert keine abschließende Hydrolyse.
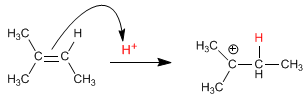
Der Mechanismus tritt mit der Bildung eines Carbokations nach Addition des Protons an die Doppelbindung auf. Die Hydratation von Alkenen ist Markovnikov, das heißt, das Proton fügt sich an den weniger substituierten Kohlenstoff des Alkens (Kohlenstoff mit mehr Wasserstoffatomen) an.
Stufe 1. Angriff des Alkens auf das Proton (elektrophile Addition)
Stufe 2. Nucleophiler Angriff von Wasser auf das gebildete Carbokation
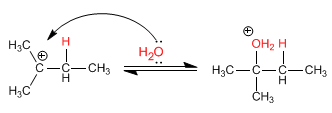
Stufe 3. Deprotonierung von Alkohol. Das Wasser dient als Basis.
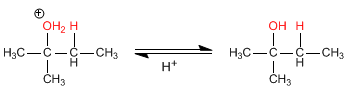
Nach dem Prinzip von Le Châtelier verschiebt sich das Gleichgewicht mit zunehmender Konzentration eines Reaktanten in Richtung des Endprodukts. Um die Ausbeute dieser Reaktion zu erhöhen, kann überschüssiges Wasser zugesetzt werden, was eine Verschiebung des Gleichgewichts in Richtung des endgültigen Alkohols bewirkt.
Die Hydratation von Alkenen ist eine Markovnikov-Reaktion.