THEORIE DER ALLYLISCHEN SYSTEME
- Details
- Germán Fernández
- THEORIE DER ALLYLISCHEN SYSTEME
- Zugriffe: 22642
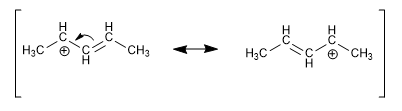
Positive, negative oder radikalische Ladungen in Positionen in der Nähe von Doppelbindungen werden durch Resonanz delokalisiert und sind besonders stabil.
- Details
- Germán Fernández
- THEORIE DER ALLYLISCHEN SYSTEME
- Zugriffe: 41671
Die Gruppe CH 2 =CHCH 2 - wird Allyl genannt. Einige Verbindungen, die sich von der Allylgruppe ableiten, sind:
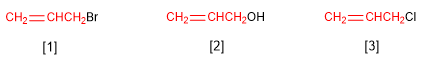
- Details
- Germán Fernández
- THEORIE DER ALLYLISCHEN SYSTEME
- Zugriffe: 25519
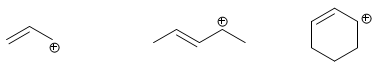
Carbokationen, die an Kohlenstoffen gebildet werden, die sich in allylischen Positionen befinden, werden Allylkationen genannt.
- Details
- Germán Fernández
- THEORIE DER ALLYLISCHEN SYSTEME
- Zugriffe: 16199
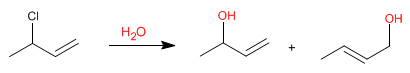
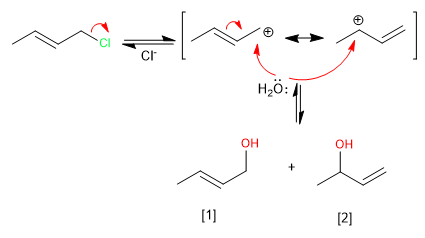
Allylische Systeme können als Substrate in nukleophilen Substitutionsreaktionen fungieren. So erzeugt die Reaktion von 3-Chlor-1-buten mit Wasser zwei Allylalkohole.
- Details
- Germán Fernández
- THEORIE DER ALLYLISCHEN SYSTEME
- Zugriffe: 3055
Die durch Resonanz stabilisierte Bildung des allylischen Carbokations ermöglicht es der Reaktion, sich auf zwei Wegen zu entwickeln, die zu den kinetischen und thermodynamischen Produkten führen.
Weiterlesen: Kinetische und thermodynamische Kontrolle in allylischen Systemen
- Details
- Germán Fernández
- THEORIE DER ALLYLISCHEN SYSTEME
- Zugriffe: 2094
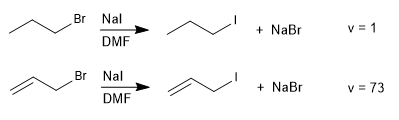
S N 2-Reaktionen mit Abgangsgruppen in allylischen Positionen verlaufen schneller als die für die entsprechenden gesättigten Halogenalkane.
- Details
- Germán Fernández
- THEORIE DER ALLYLISCHEN SYSTEME
- Zugriffe: 2089
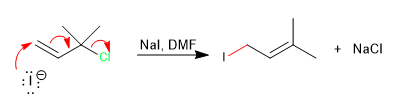
Mit tertiären Allylsubstraten und unter S N 2-Bedingungen (gutes Nucleophil und aprotisches Lösungsmittel) wird eine konzertierte Reaktion erzeugt, indem das Nucleophil den Kohlenstoff der Doppelbindung unter Verlust der Abgangsgruppe angreift.
- Details
- Germán Fernández
- THEORIE DER ALLYLISCHEN SYSTEME
- Zugriffe: 1993
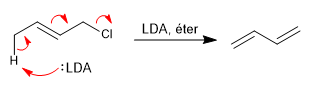
Starke und gehinderte Basen ergeben meistens E2 mit allylischen Systemen, wobei der Kohlenstoff in Position 4 in Bezug auf die Abgangsgruppe deprotoniert wird.
- Details
- Germán Fernández
- THEORIE DER ALLYLISCHEN SYSTEME
- Zugriffe: 2665
Halogene können an Alkene addieren, was vicinale Dihalogenalkane ergibt, aber wenn diese Reaktion bei niedrigen Halogenkonzentrationen durchgeführt wird, werden radikalische Mechanismen bevorzugt. Ein weit verbreitetes Reagenz bei allylischen Bromierungen ist NBS (N-Bromsuccinimid).
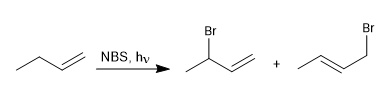
- Details
- Germán Fernández
- THEORIE DER ALLYLISCHEN SYSTEME
- Zugriffe: 2069
Die konjugierten Diene addieren die Säuren der Halogene zu kinetischen und thermodynamischen Produkten, deren Verhältnis durch die Reaktionsbedingungen (Temperatur und Zeit) gesteuert werden kann.
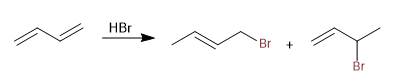
Weiterlesen: Säureaddition von Halogenen (HX) an konjugierte Diene
- Details
- Germán Fernández
- THEORIE DER ALLYLISCHEN SYSTEME
- Zugriffe: 2050
Im Gegensatz zur Addition von Brom an Alkene bilden konjugierte Diene aufgrund der hohen Stabilität des gebildeten Carbokations keine Haloniumionen.
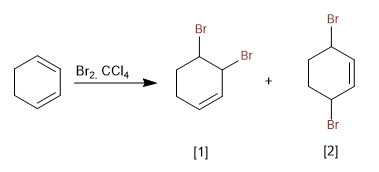
[1 ] Additionsprodukt 1,2
[2 ] Additionsprodukt 1.4