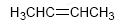 Jeder Ring oder Zyklus eines Moleküls impliziert den Verlust von zwei Wasserstoffatomen in Bezug auf ein Alkan der Formel C n H 2n+2 . Der Ungesättigtheitsgrad ist die Anzahl der Zyklen und Doppelbindungen, die in einem Molekül vorhanden sind.
Jeder Ring oder Zyklus eines Moleküls impliziert den Verlust von zwei Wasserstoffatomen in Bezug auf ein Alkan der Formel C n H 2n+2 . Der Ungesättigtheitsgrad ist die Anzahl der Zyklen und Doppelbindungen, die in einem Molekül vorhanden sind.
Da Alkane die größtmögliche Anzahl an Kohlenstoff-Wasserstoff-Bindungen enthalten, werden sie als gesättigte Kohlenwasserstoffe bezeichnet. Alkene und zyklische Verbindungen sind ungesättigte Kohlenwasserstoffe. 
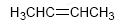
Die Gesamtzahl der π-Bindungen und Zyklen in einem Molekül wird als Ungesättigtheitsgrad bezeichnet. 
![Bicyclo[3.3.0]nonan biciclo[3.3.0]nonano](/images/stories/organica-i/alquenos/insaturaciones/biciclo330nonano.gif)
Ungesättigtheitsgrad in halogen-, sauerstoff- und stickstoffhaltigen Verbindungen:
Halogene: Addiere die Anzahl der Halogene zur Anzahl der Wasserstoffatome.
Sauerstoff: Ignorieren Sie die Sauerstoffe.
Stickstoffe : Subtrahiere die Anzahl der Stickstoffe von der Anzahl der Wasserstoffe.
Beispiel 1: Berechnen Sie den Ungesättigtheitsgrad in den folgenden Formeln :
a ) C4H8
Lösung: Ein gesättigtes 4-Kohlenstoff-Alkan hat die Formel C 4 H 10 . Die Verbindung hat ein Wasserstoffpaar weniger, also ist ihr Ungesättigtheitsgrad eins.
b ) C9H16Br2
Lösung: Wir addieren die Halogene zu den Wasserstoffen und erhalten die Formel C 9 H 18 . Ein gesättigtes Alkan mit 9 Kohlenstoffatomen hat die Formel C 9 H 20 . Die Verbindung hat eine Ungesättigtheit.