TEORI ALKANA
- Detail
- Germán Fernández
- TEORI ALKANA
- Dilihat: 2152
Apa itu alkana?
Alkana adalah senyawa yang dibentuk secara eksklusif oleh karbon dan hidrogen (hidrokarbon), yang hanya mengandung ikatan karbon-karbon sederhana.
jenis alkana
Alkana diklasifikasikan sebagai linier, bercabang, siklik, dan polisiklik.
Nomenklatur alkana
Alkana diberi nama dengan akhiran -ana awalan yang menunjukkan jumlah karbon dalam molekul (metana, etana, propana ...)
Sifat fisik alkana
Titik leleh dan titik didih alkana rendah dan meningkat seiring bertambahnya jumlah karbon akibat interaksi antar molekul oleh gaya London. Alkana linier memiliki titik didih lebih tinggi daripada isomer bercabangnya.
isomer konformasi
Alkana tidak kaku karena spin di sekitar ikatan CC. Berbagai bentuk yang diciptakan oleh rotasi ini disebut konformasi.
Proyeksi Newman
Energi dari konformasi yang berbeda dapat dilihat pada proyeksi Newman. Jadi, dalam kasus etana, konformasi gerhana adalah konformasi dengan energi tertinggi, karena tolakan antara hidrogen.
diagram energi potensial
Konformasi alkana yang berbeda dapat direpresentasikan dalam diagram energi potensial, di mana kita dapat melihat konformasi mana yang lebih stabil (energi minimum) dan energi yang dibutuhkan untuk berpindah dari satu konformasi ke konformasi lainnya.
pembakaran alkana
Mengingat reaktivitasnya yang rendah, alkana juga disebut parafin. Reaksi terpenting dari kelompok senyawa ini adalah halogenasi radikal dan pembakaran. Pembakaran adalah kombinasi hidrokarbon dengan oksigen untuk membentuk karbon dioksida dan air.
- Detail
- Germán Fernández
- TEORI ALKANA
- Dilihat: 242198
Hidrokarbon adalah senyawa yang hanya mengandung karbon dan hidrogen. Mereka dibagi menjadi dua kelas: hidrokarbon alifatik dan aromatik.
Hidrokarbon alifatik mencakup tiga kelas senyawa: alkana, alkena, dan alkin. Alkana adalah hidrokarbon yang hanya mengandung ikatan tunggal karbon-karbon, alkena mengandung ikatan rangkap karbon-karbon, dan alkuna adalah hidrokarbon yang mengandung satu ikatan rangkap tiga. 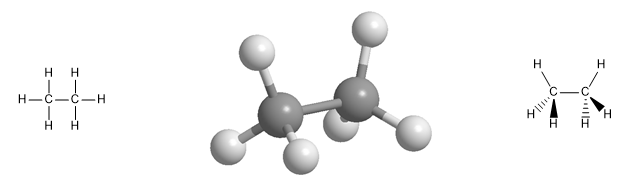
Model molekul molekul etana. Etana memiliki geometri tetrahedral, dengan karbon di pusat tetrahedron dan hidrogen berorientasi pada simpulnya. Perhatikan representasi spasial dengan irisan dan garis putus-putus .
- Detail
- Germán Fernández
- TEORI ALKANA
- Dilihat: 181686
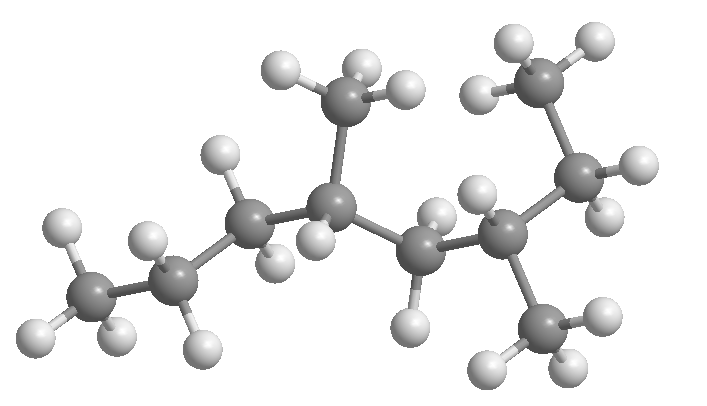
Alkana adalah senyawa yang terdiri dari karbon dan hidrogen yang hanya mengandung ikatan tunggal karbon-karbon. Mereka memenuhi rumus umum C n H 2n+2 , di mana n adalah jumlah karbon dalam molekul.
Alkana yang karbonnya berikatan terus menerus (tanpa cabang) disebut alkana rantai lurus .
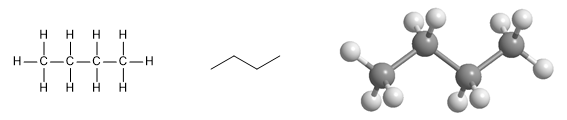
Molekul butana. Gambar pertama menunjukkan bentuk penyatuan atom, yang kedua bentuk zig-zag molekul dan terakhir model molekulnya, di mana susunan spasial atom diamati.
- Detail
- Germán Fernández
- TEORI ALKANA
- Dilihat: 368648
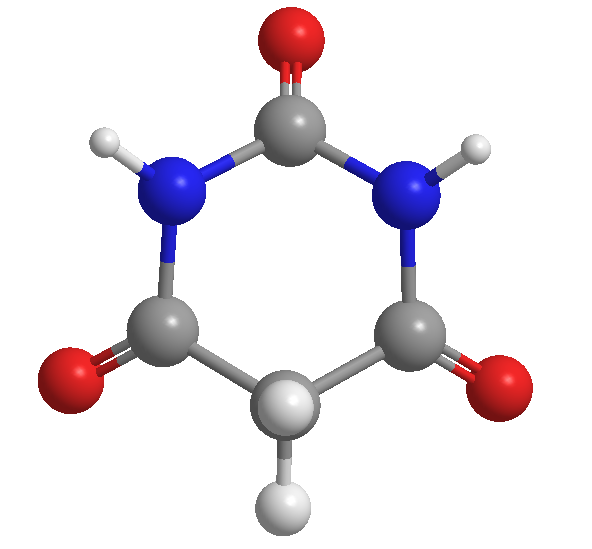
Asam barbiturat, ditemukan oleh Adolf von Baeyer, pada tahun 1864
Dalam asal-usul kimia, senyawa organik diberi nama oleh penemunya. Urea mendapatkan namanya karena diisolasi dari urin.
Asam barbiturat ditemukan oleh ahli kimia Jerman Adolf von Baeyer pada tahun 1864. Diperkirakan bahwa dia memberinya nama ini untuk menghormati seorang teman bernama Barbara.
Ilmu kimia semakin maju dan banyaknya senyawa organik yang ditemukan membuatnya penting untuk menggunakan tata nama yang sistematis.

[1] isobutana (nama umum); metilpropana (nama IUPAC)
[2] isopentana (nama umum); metilbutana (nama IUPAC)
Dalam sistem nomenklatur IUPAC, sebuah nama terdiri dari tiga bagian: awalan, utama, dan akhiran; Awalan menunjukkan substituen molekul; akhiran menunjukkan gugus fungsi molekul; dan bagian utama jumlah karbon yang dimilikinya.
Alkana dapat diberi nama mengikuti tujuh langkah:
Aturan 1.- Tentukan jumlah karbon dari rantai terpanjang, yang disebut rantai utama alkana. Amati pada gambar bahwa tidak selalu merupakan rantai horizontal.
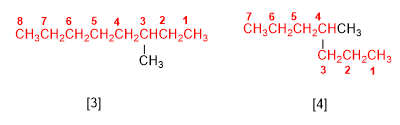
[3] 3-metiloktana
[4] 4-metilheptana
- Detail
- Germán Fernández
- TEORI ALKANA
- Dilihat: 62689
Aturan 1. Nama senyawa bisiklik dibangun dengan kata Bicyclo, diikuti dengan tanda kurung yang menunjukkan jumlah karbon di masing-masing dari tiga rantai yang dimulai dari karbon kepala jembatan. Nama diakhiri dengan nama alkana dengan jumlah karbon yang sama.

[1] Bisiklo[2.2.1]heptana
[2] Bicyclo[3.2.1]oktan
[xxx] Karbon jembatan dari senyawa bisiklik digambar dengan titik biru. Jumlah karbon di masing-masing rantai ini (diberi nomor merah) ditunjukkan di dalam tanda kurung, tanpa menghitung karbon kepala jembatan. Perhatikan bahwa angka diurutkan dari tertinggi ke terendah dan dipisahkan oleh titik (bukan koma).
Nama senyawa bisiklik diakhiri dengan nama alkana dengan jumlah karbon yang sama.
- Detail
- Germán Fernández
- TEORI ALKANA
- Dilihat: 196445
Metana (CH 4 ), etana (C 2 H 6 ) dan propana (C 3 H 8 ) adalah alkana dengan hanya satu kemungkinan struktur. Namun, ada dua alkana dengan rumus C 4 H 10 ; butana dan 2-metilpropana. Alkana ini dengan rumus yang sama tetapi struktur yang berbeda disebut isomer.

[1] Butana
[2] 2-Metilpropana
n-Butana dan isobutana memiliki rumus yang sama tetapi berbeda dalam cara penggabungan atomnya -mereka adalah isomer struktural-. Struktur mereka yang berbeda membuat mereka memiliki sifat yang berbeda, sehingga mereka berbeda sekitar 20ºC pada titik lelehnya dan sekitar 10ºC pada titik didihnya.
- Detail
- Germán Fernández
- TEORI ALKANA
- Dilihat: 276550
Alkana adalah senyawa hibridisasi sp 3 pada semua karbon. Empat substituen yang dimulai dari setiap karbon disusun menuju simpul tetrahedron.
Jarak dan sudut ikatan ditunjukkan pada model berikut. 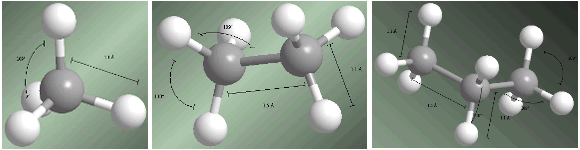
- Detail
- Germán Fernández
- TEORI ALKANA
- Dilihat: 146033
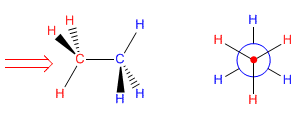 Proyeksi Newman diperoleh dengan melihat molekul sepanjang sumbu CC. Karbon depan diwakili oleh sebuah titik, dari mana tiga ikatan yang bergabung dengan substituen dimulai. Karbon di belakang diwakili oleh lingkaran, dan ikatan yang meninggalkan karbon ini ditarik dari lingkaran ini.
Proyeksi Newman diperoleh dengan melihat molekul sepanjang sumbu CC. Karbon depan diwakili oleh sebuah titik, dari mana tiga ikatan yang bergabung dengan substituen dimulai. Karbon di belakang diwakili oleh lingkaran, dan ikatan yang meninggalkan karbon ini ditarik dari lingkaran ini.
- Detail
- Germán Fernández
- TEORI ALKANA
- Dilihat: 117478
 Ikatan tunggal antar atom memiliki simetri silinder dan memungkinkan rotasi kelompok atom yang melekat padanya. Pengaturan spasial berbeda yang diadopsi atom sebagai hasil rotasi di sekitar ikatan disebut konformasi. Sebuah konformasi tertentu dari banyak yang mungkin disebut konformer.
Ikatan tunggal antar atom memiliki simetri silinder dan memungkinkan rotasi kelompok atom yang melekat padanya. Pengaturan spasial berbeda yang diadopsi atom sebagai hasil rotasi di sekitar ikatan disebut konformasi. Sebuah konformasi tertentu dari banyak yang mungkin disebut konformer.
- Detail
- Germán Fernández
- TEORI ALKANA
- Dilihat: 115100
Etana adalah alkana paling sederhana yang dapat eksis dalam berbagai konformasi. Dari konformasi tak terhingga yang dapat diperoleh dengan memutar ikatan karbon-karbon, konformasi bergantian dan gerhana menonjol karena kepentingannya.
- Detail
- Germán Fernández
- TEORI ALKANA
- Dilihat: 89615
Mari pertimbangkan ikatan butana C2-C3. Putaran 60º di sekitar tautan ini akan menghasilkan kemungkinan konformasi butana. Ada tiga konformasi yang sangat penting disebut; butana tanpa , butana anti dan butana gauche yang kami wakili dalam model berikut.