Dans la réaction d'élimination du 5-bromononane avec l'éthoxyde de potassium dans l'éthanol, dessinez des projections de Newmann montrant la conformation conduisant au cis-4-nonène et au trans-4-nonène, respectivement. Indiquez l'hydrogène qui est perdu dans chaque cas et suggérez un mécanisme qui explique la stéréosélectivité observée.
Solution
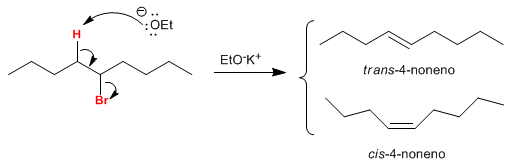
Sur le carbone b de l'haloalcane, il y a deux hydrogènes qui, lorsqu'ils sont placés en anti par rapport au groupe partant, génèrent les deux isomères. L'isomère trans est obtenu en plus grande quantité, car l'état de transition de la réaction qui le forme est de moindre énergie.
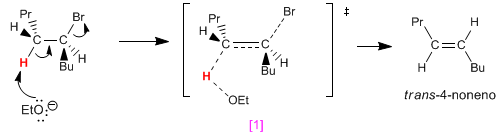
En tournant le carbone à gauche de 120º, nous plaçons l'hydrogène noir anti par rapport au brome. L'élimination de cet hydrogène forme l'alcène cis.
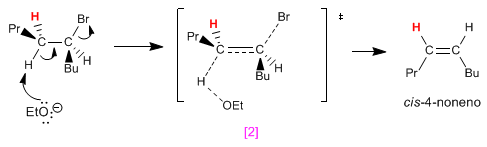
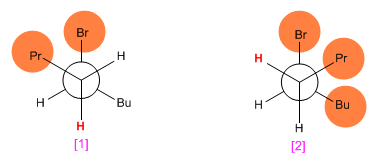
En faisant des projections de Newmann des deux conformations, on observe que [1] a moins de répulsions (propyle et butyle vers les côtés opposés) que [2] . Cela fait que l'isomère trans est obtenu en plus grande quantité que le cis (la réaction qui forme le produit trans est plus rapide car il a une énergie d'activation plus faible).