Die a,b -ungesättigten Verbindungen sind Verbindungen mit zwei elektrophilen Positionen: dem Carbonylkohlenstoff und dem b- Kohlenstoff.
Ergänzungen 1,2. Organometallische Lithiumverbindungen greifen den Carbonylkohlenstoff an, was zu 1,2-Additionen führt.
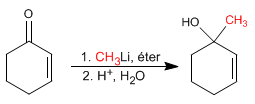
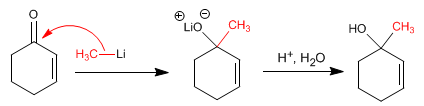
{nota} Die Organometalle von Lithium und Magnesium greifen den Carbonylkohlenstoff der a,b- ungesättigten Verbindungen an{/nota}
Additionsmechanismus 1.2
Ergänzungen 1.4. Cuprate, Cyanide und andere Nucleophile greifen den b- Kohlenstoff von a,b -ungesättigten Verbindungen an und ergeben 1,4-Additionen.
{Anmerkung} Blausäure ergibt 1,4-Additionen mit a,b -ungesättigt. Das Cyano ist an Kohlenstoff b gebunden.{/nota}
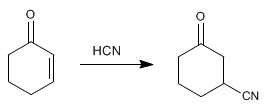
Mechanismus der Addition von Blausäure an Cyclohex-2-enon
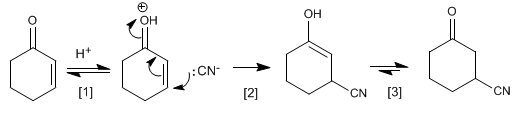
[1] Protonierung des Carbonyls
[2] Nucleophiler Angriff von Cyanid auf Kohlenstoff b .
[3] Keto-Enol-Tautomerie.
{nota}Cuprate sind metallorganische Kupferverbindungen, die zum b- Kohlenstoff von a,b- ungesättigten Verbindungen hinzugefügt werden.{/nota}
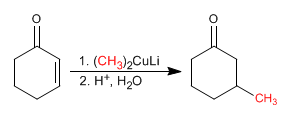
Der Reaktionsmechanismus beginnt mit dem nukleophilen Angriff des Cuprats am b- Kohlenstoff unter Bildung eines Enolats, das in der zweiten Stufe zu einem Enol protoniert wird. Das Enol tautomerisiert zu einem Keton und erzeugt das Endprodukt.
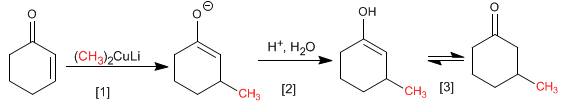
[1 ] Nucleophile Addition von Cuprat.
[2] Protonierung des Enolats
[3] Keto-Enol-Tautomerie