Intramolekulare Cyclisierung (Williamson intramolecular): Halogenierte Alkohole in Position 2 cyclisieren in basischen Medien zu Oxiranen.
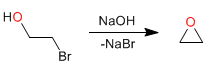
Mechanismus:
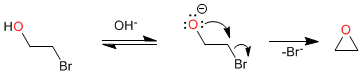
Die erste Stufe des Mechanismus besteht aus einem Säure-Basen-Gleichgewicht, das den Alkohol depotifiziert und ein gutes Nucleophil (Alkoxid) erzeugt, das in der zweiten Stufe durch ein intramolekulares S N 2 cyclisiert.
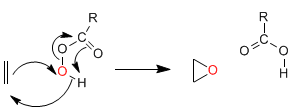
Alkenepoxidation: Persäuren (MCPBA) reagieren mit Alkenen zu Oxiranen (Epoxiden).

Mechanismus:
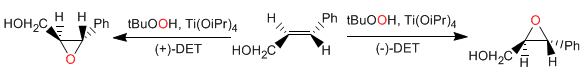
Asymmetrische Sharples-Epoxidierung: Allylalkohole reagieren enantioselektiv mit Titantetraisopropoxid, tert-Butylhydroperoxid und (+)- oder (-)-Diethyltartrat zu Oxiranen.
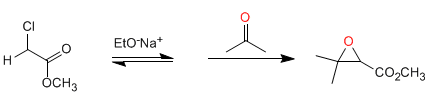
Darzens-Synthese: Die Reaktion geht von halogenierten Estern in alpha-Position aus, die in basischem Medium Enolate bilden. Die Reaktion des Enolatesters mit Aldehyden oder Ketonen, gefolgt von intramolekularem S N 2 , erzeugt Oxirane.
Mechanismus:
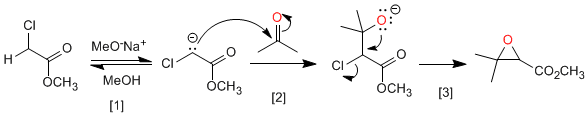
[1] Ester-Deprotonierung.
[2] Nucleophiler Angriff des Enolatesters auf das Carbonyl.
[3 ] Intramolekulare nukleophile Substitution, die Oxiran erzeugt.
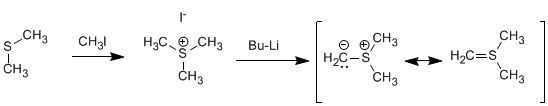
Corey-Synthese (Schwefel-Ylide): Schwefel-Ylide reagieren mit Aldehyden oder Ketonen zu Oxiranen.
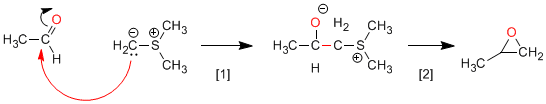
[1] Nucleophiler Angriff des Ylids auf das Carbonyl.
[2] Cyclisierungsstufe unter Ausnutzung der Kapazität von Schwefel als Abgangsgruppe.
Schwefelylid wird durch Methylierung von Dimethylsulfid und anschließende Behandlung mit einer starken Base hergestellt.