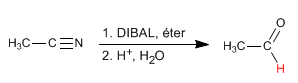TEORI NITRIL
- Detail
- Germán Fernández
- TEORI NITRIL
- Dilihat: 41146
IUPAC menamai nitril dengan menambahkan akhiran -nitril pada nama alkana dengan jumlah karbon yang sama.
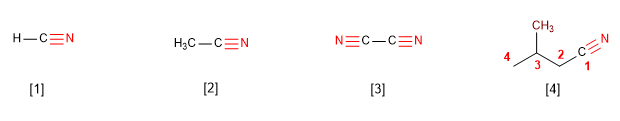
[1] Metananitril
[2] Etanonitril
[3] Ethanedinitril
[4] 3-Metilbutananitril
- Detail
- Germán Fernández
- TEORI NITRIL
- Dilihat: 47229
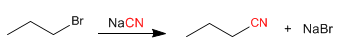
a) Dari haloalkana: Nitril dapat dibuat dari haloalkana, dengan proses SN2. Reaksi memberikan kinerja yang baik dengan substrat primer dan sekunder, yang tersier lebih disukai dihilangkan, membentuk alkena.
- Detail
- Germán Fernández
- TEORI NITRIL
- Dilihat: 44508
Nitril terhidrolisis dalam media asam, di bawah pemanasan, menjadi asam karboksilat dan garam amonium. Hidrolisis nitril adalah proses ireversibel.
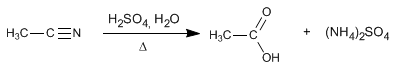
- Detail
- Germán Fernández
- TEORI NITRIL
- Dilihat: 35830
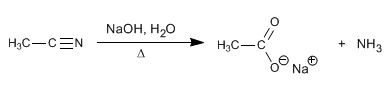
Nitril dihidrolisis dengan soda berair, di bawah pemanasan, untuk membentuk karboksilat dan amonia.
- Detail
- Germán Fernández
- TEORI NITRIL
- Dilihat: 25767
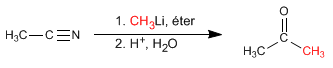
- Detail
- Germán Fernández
- TEORI NITRIL
- Dilihat: 16458
Nitril menghadirkan hidrogen menjadi asam yang dapat dihilangkan dengan basa kuat, membentuk enolat nitril. Hidrogen ini memiliki pKa 25.
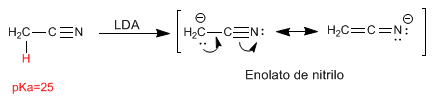
- Detail
- Germán Fernández
- TEORI NITRIL
- Dilihat: 29142
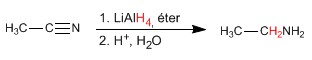
- Detail
- Germán Fernández
- TEORI NITRIL
- Dilihat: 22939
DIBAL (diisobutylaluminum hydride) mereduksi nitril menjadi aldehida