Säurederivate verhalten sich durch Carbonylsauerstoff wie Basen. Die Basizität dieses Sauerstoffs hängt von der Resonanzstabilisierung der konjugierten Säure ab.
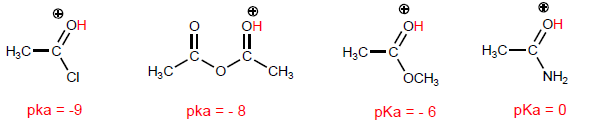
Vergleichen wir die Strukturen, die die Base auf dem Halogenid und dem Amid stabilisieren.
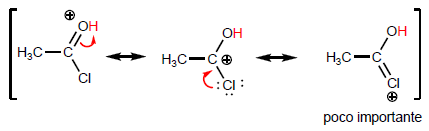
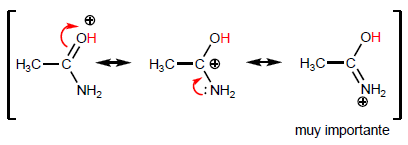
Wenn die letzte Struktur an Gewicht zunimmt, wird die Säure stabiler (schwächer) und daher die Base stärker. Amide sind die stärksten Basen aller Säurederivate.
Säurederivate weisen saure Wasserstoffatome auf Kohlenstoff auf.
Alkanoylhalogenide haben die sauersten Wasserstoffatome in der a- Position, während Amide die am wenigsten saueren haben.
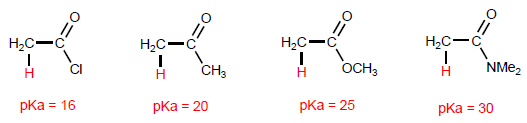
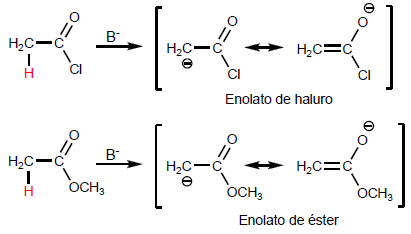
Die Deprotonierung der Position erzeugt Enolate
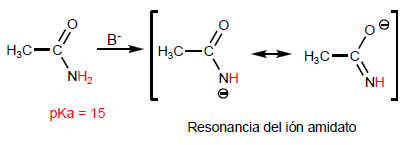
Amide haben am Stickstoffatom sehr saure Wasserstoffatome, deren Subtraktion Amidate bildet.