Il existe plusieurs critères pour déterminer le degré d'aromaticité d'un hétérocycle :
A) Longueurs des liens.
Un hétérocycle est d'autant plus aromatique que la différence entre les longueurs des différentes liaisons qui composent le cycle est faible. Le benzène a la même longueur dans toutes ses liaisons carbone-carbone, ce qui en fait le composé le plus aromatique. Les hétérocycles présentent des différences dans les distances de liaison, d'autant moins aromatiques que ces différences sont grandes.
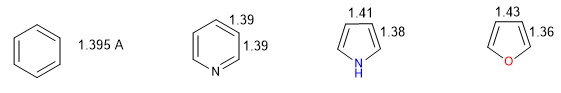
Toutes les liaisons CC dans le benzène mesurent 1,395 A, une distance de liaison intermédiaire entre les liaisons simples (1,48 A) et doubles (1,34 A). Dans le furane, il existe une différence notable entre la longueur des liaisons, indiquant une plus faible aromaticité que dans le pyrrole. La pyridine, en revanche, a des distances de liaison CC très similaires entre elles et similaires à celles du benzène, qui présente une plus grande aromaticité que le pyrrole ou le furane.
B) Données de résonance magnétique nucléaire.
Une autre mesure du degré d'aromaticité consiste à comparer les constantes de couplage des différents hydrogènes. Si les distances de liaison entre les carbones sont les mêmes, les constantes de couplage entre les hydrogènes qui leur sont attachés sont également les mêmes. Les systèmes aromatiques présentent un déplacement chimique entre 7 et 8,5 ppm dû au phénomène d'anisotropie magnétique.
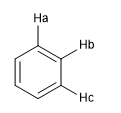
J ab = J bc si les distances C a - C b et C b - C c sont égales, ce qui montre un système fortement aromatique.
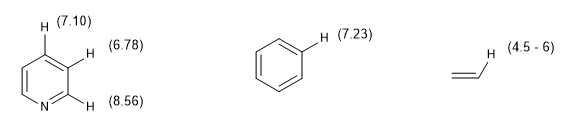
Le déplacement chimique des hydrogènes aromatiques permet de les distinguer facilement des hydrogènes vinyliques.
C) Énergies de résonance.
Les données REPE (énergie de résonance par électron pi) sont utilisées pour comparer le degré d'aromaticité de différents hétérocycles.
Le REPE est obtenu en divisant l'énergie de résonance d'un système par le nombre d'électrons pi qu'il possède. Nous pouvons définir l'énergie de résonance comme la différence d'énergie entre la molécule avec des liaisons localisées et délocalisées.
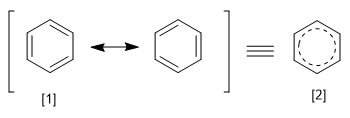
[1] Structure canonique
[2 ] Hybride de résonance
| Composé | RÉPÉTER |
| Benzène pyridine pyrimidine pyrrole thiophène furanne |
0,065 0,058 0,049 0,039 0,032 0,007 |
Plus l'hétéroatome est électronégatif, moins l'hétérocycle présente d'aromatique, car les électrons pi sont attirés vers lui et la conjugaison diminue. Ce facteur explique l'aromaticité plus élevée du pyrrole par rapport au furane. Dans les hétérocycles avec des hétéroatomes d'électronégativité similaire, mais dans lesquels un hétéroatome a des orbitales d, celui sans orbitales d présente une plus grande aromaticité. Les orbitales D, étant plus diffuses, donnent des chevauchements moins efficaces avec les atomes de carbone et altèrent la conjugaison. Ce facteur explique l'aromaticité plus élevée du pyrrole par rapport au thiophène.