Es gibt mehrere Kriterien, um den Aromatizitätsgrad eines Heterocyclus zu bestimmen:
A) Verbindungslängen.
Ein Heterocyclus ist umso aromatischer, je geringer der Unterschied zwischen den Längen der verschiedenen Bindungen ist, aus denen der Ring besteht. Benzol hat in allen seinen Kohlenstoff-Kohlenstoff-Bindungen die gleiche Länge, was es zur aromatischsten Verbindung macht. Die Heterocyclen weisen Unterschiede in den Bindungsabständen auf, wobei sie umso weniger aromatisch sind, je größer diese Unterschiede sind.
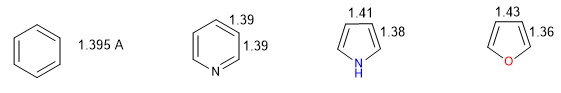
Alle CC-Bindungen in Benzol messen 1,395 Å, ein mittlerer Bindungsabstand zwischen Einfach- (1,48 Å) und Doppelbindungen (1,34 Å). In Furan gibt es einen bemerkenswerten Unterschied in der Länge der Bindungen, was auf eine geringere Aromatizität als in Pyrrol hinweist. Pyridin hingegen hat sehr ähnliche CC-Bindungsabstände zwischen ihnen und ähnlich denen von Benzol, das eine größere Aromatizität als Pyrrol oder Furan zeigt.
B) Kernmagnetische Resonanzdaten.
Ein weiteres Maß für den Aromatizitätsgrad besteht im Vergleich der Kopplungskonstanten der verschiedenen Wasserstoffatome. Wenn die Bindungsabstände zwischen Kohlenstoffen gleich sind, sind auch die Kopplungskonstanten zwischen den daran gebundenen Wasserstoffatomen gleich. Aromatische Systeme weisen aufgrund des Phänomens der magnetischen Anisotropie eine chemische Verschiebung zwischen 7 und 8,5 ppm auf.
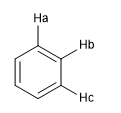
J ab = J bc wenn die Abstände C a - C b und C b - C c gleich sind, was ein hocharomatisches System zeigt.
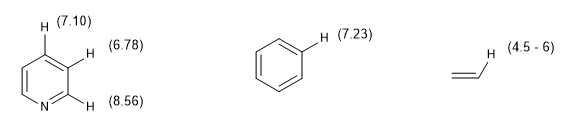
Die chemische Verschiebung aromatischer Wasserstoffe macht es einfach, sie von Vinylwasserstoffen zu unterscheiden.
C) Resonanzenergien.
REPE-Daten (Resonanzenergie pro Elektron pi) werden verwendet, um den Aromatizitätsgrad verschiedener Heterocyclen zu vergleichen.
Die REPE erhält man, indem man die Resonanzenergie eines Systems durch die Anzahl der Pi-Elektronen dividiert, die es besitzt. Wir können die Resonanzenergie als die Energiedifferenz zwischen dem Molekül mit lokalisierten und delokalisierten Bindungen definieren.
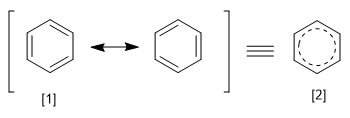
[1] Kanonische Struktur
[2] Resonanz-Hybrid
| Verbindung | WIEDERHOLEN |
| Benzol Pyridin Pyrimidin Pyrrol Thiophen furan | 0,065 0,058 0,049 0,039 0,032 0,007 |
Je elektronegativer das Heteroatom ist, desto weniger aromatisch präsentiert sich der Heterocyclus, da die Pi-Elektronen davon angezogen werden und die Konjugation abnimmt. Dieser Faktor erklärt die höhere Aromatizität von Pyrrol im Vergleich zu Furan. In Heterocyclen mit Heteroatomen ähnlicher Elektronegativität, bei denen jedoch ein Heteroatom d-Orbitale aufweist, weist dasjenige ohne d-Orbitale eine größere Aromatizität auf. D-Orbitale, die diffuser sind, ergeben weniger effektive Überlappungen mit Kohlenstoffatomen und beeinträchtigen die Konjugation. Dieser Faktor erklärt die höhere Aromatizität von Pyrrol im Vergleich zu Thiophen.