Dans cette section nous verrons des exemples de synthèse d'hétérocycles par attaque nucléophile sur des groupements carbonyles. Les carbonyles d'aldéhyde et de cétone donnent lieu à des réactions d'addition nucléophiles, tandis que les carbonyles de dérivés acides (halogénures, anhydrides, esters, amides, nitriles) donnent lieu à des processus d'addition-élimination.
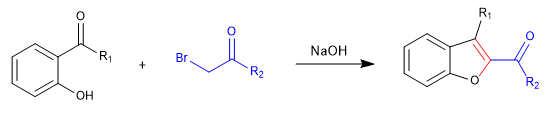
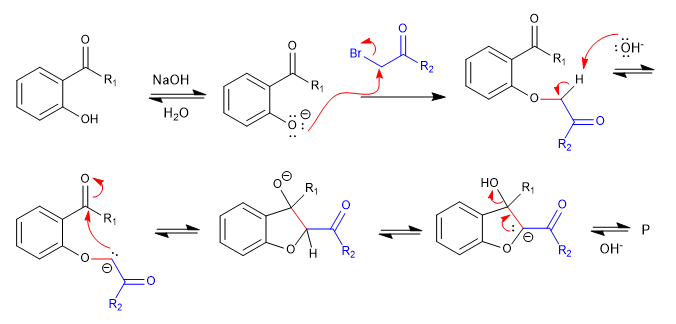
A) On commence par la synthèse d'un benzofurane.
Dans la première étape, nous joignons les réactifs au moyen d'un S N 2 et nous finissons par cyclage avec une réaction d'aldolisation.
Mécanisme:
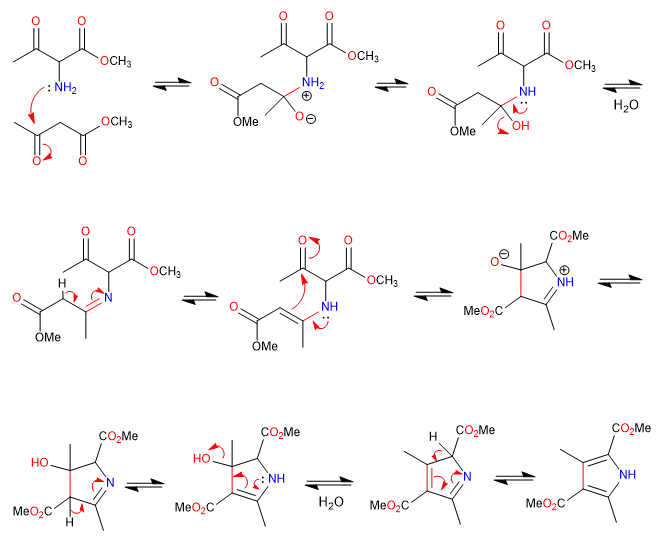
B) On poursuit la synthèse d'un pyrrole par formation d'imine et cyclisation avec attaque d'énamine sur carbonyle.
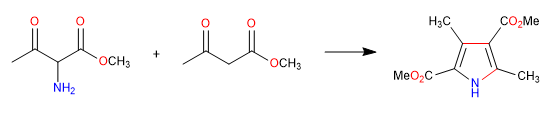
Mécanisme:
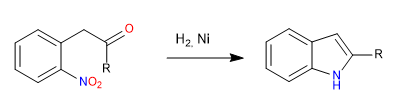
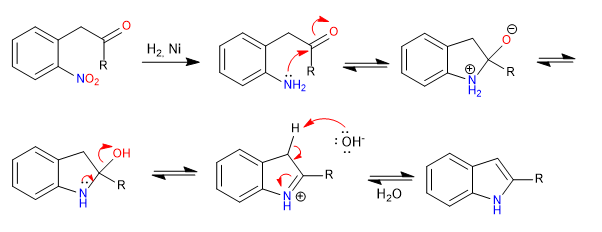
C) Obtention d'indole par attaque d'hétéroatomes nucléophiles en carbonyle.
Mécanisme:
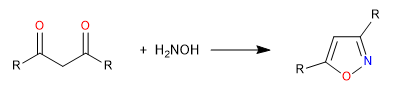
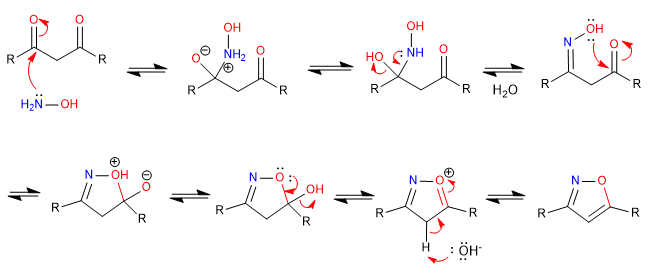
D) On continue avec un autre exemple de cyclisation par attaque d'hétéroatomes sur des carbonyles. Dans ce cas, l'hydroxylamine agit comme un nucléophile pour former un isoxazole.
Mécanisme:
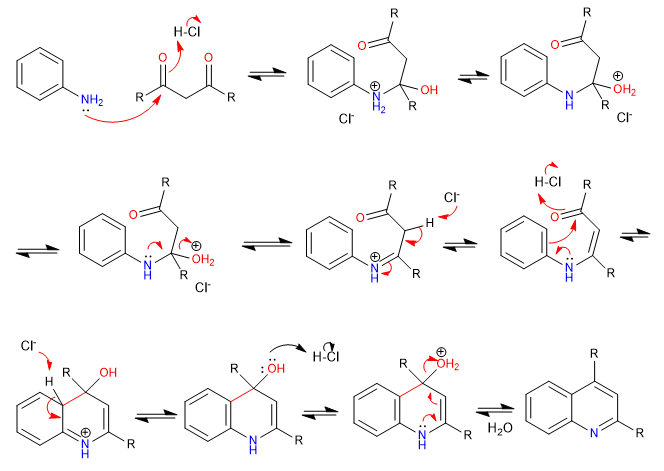
E) Cyclisation sur une position ortho d'un cycle benzénique, pour donner de la quinoléine.
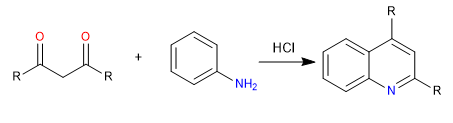
Mécanisme: