A) Hétérocycles à 6 atomes et 6 électrons p .
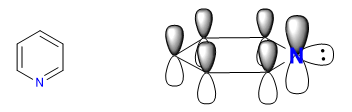
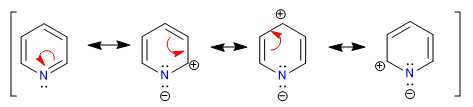
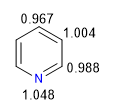
L'azote plus électronégatif attire le nuage d'électrons vers lui, laissant derrière lui les carbones déficients en électrons. Par conséquent, ce système est considéré comme pi déficient en benzène. Dans l'image suivante, je représente les densités de charge moyennes que chaque carbone supporte, dans un benzène tous les carbones supporteraient une densité de 1.
L'électronégativité de l'azote provoque la rétention du nuage électronique sur celui-ci, diminuant l'aromaticité du système, ainsi que sa capacité à attaquer les électrophiles. Cependant, les réactions qui procèdent à une attaque nucléophile sur le cycle sont favorisées.
Huit types de composés aza dérivés du benzène sont connus :
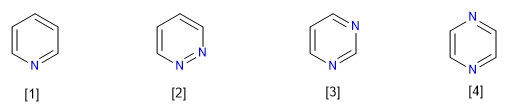
[1] Pyridine
[2] Pyridazine
[3] Pyrimidine
[4] Pyrazine
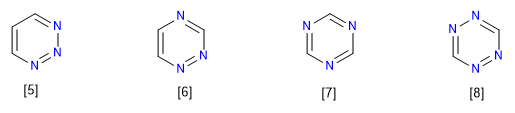
[5] 1,2,3-Triazine
[6] 1,2,4-Triazine
[7] 1,3,5-Triazine
[8] 1,2,3,5-tétrazine
Les autres hétérocycles appartenant à cette famille avec un hétéroatome autre que l'azote sont :
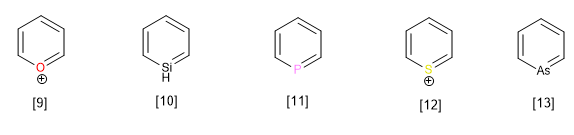
[9] Cation pyryllium
[10] Silabenzène
[11] Phosphabenzène
[12] Cation thiopyrilium
[13] Arsabenzène
B) Hétérocycles de 5 atomes et 6 électrons pi.
Ce sont des composés à excès électronique ou p -surplus. Les carbones ont une densité de charge plus élevée que le benzène, ce qui les rend très réactifs vis-à-vis des électrophiles mais diminue considérablement leur réactivité vis-à-vis des nucléophiles. Un membre typique de cette famille est le pyrrole.
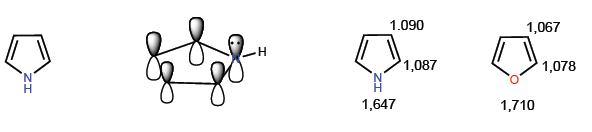
Les membres les plus représentatifs de cette famille d'hétérocycles sont :
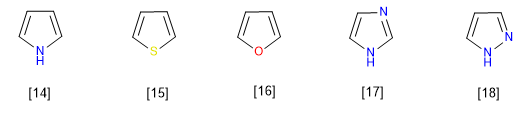
[14] Pyrrole
[15] Thiophène
[16] Furane
[17] Imidazole
[18] Pyrazole
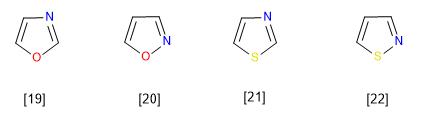
[19] Oxazole
[20] Isoxazole
[21] Thiazole
[22] Isothiazole
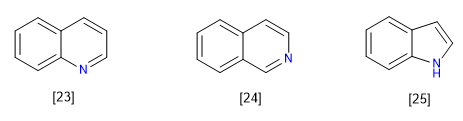
C) Systèmes condensés ou fusionnés