Ada beberapa kriteria untuk menentukan tingkat aromatisitas suatu heterocycle:
A) Panjang tautan.
Heterocycle semakin aromatik, semakin kecil perbedaan antara panjang ikatan berbeda yang membentuk cincin. Benzena memiliki panjang yang sama di semua ikatan karbon-karbonnya, yang membuatnya menjadi senyawa yang paling aromatik. Heterocycles menyajikan perbedaan jarak ikatan, menjadi kurang aromatik semakin besar perbedaan ini.
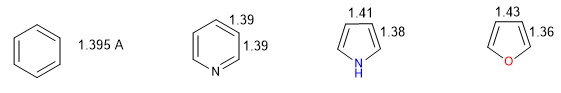
Semua ikatan CC dalam benzena berukuran 1,395 A, jarak ikatan antara antara ikatan tunggal (1,48 A) dan rangkap dua (1,34 A). Dalam furan ada perbedaan mencolok antara panjang ikatan, menunjukkan aromatisitas yang lebih rendah daripada pirol. Piridin, di sisi lain, memiliki jarak ikatan CC yang sangat mirip di antara mereka dan mirip dengan benzena, yang menunjukkan aromatisitas lebih besar daripada pirol atau furan.
B) Data resonansi magnetik nuklir.
Ukuran lain dari tingkat aromatisitas terdiri dari membandingkan konstanta kopling dari hidrogen yang berbeda. Jika jarak ikatan antara karbon sama, konstanta kopling antara hidrogen yang terikat padanya juga sama. Sistem aromatik menghadirkan pergeseran kimia antara 7 dan 8,5 ppm karena fenomena anisotropi magnetik.
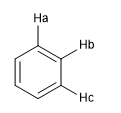
J ab = J bc jika jarak C a - C b dan C b - C c sama, yang menunjukkan sistem yang sangat aromatik.
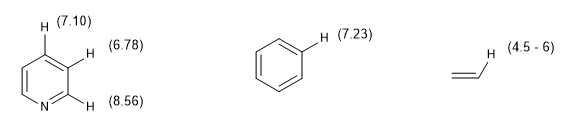
Pergeseran kimia hidrogen aromatik memudahkan untuk membedakannya dari hidrogen vinil.
C. Energi resonansi.
Data REPE (energi resonansi per elektron pi) digunakan untuk membandingkan tingkat aromatisitas dari berbagai heterosiklus.
REPE diperoleh dengan membagi energi resonansi suatu sistem dengan jumlah elektron pi yang dimilikinya. Kita dapat mendefinisikan energi resonansi sebagai perbedaan energi antara molekul dengan ikatan terlokalisasi dan terdelokalisasi.
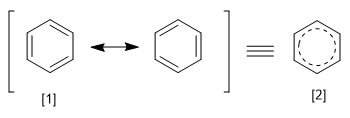
[1] Struktur kanonis
[2 ] Hibrida Resonansi
| Menggabungkan | MENGULANG |
| Benzena piridin pirimidin pirol tiofena furan | 0,065 0,058 0,049 0,039 0,032 0,007 |
Semakin elektronegatif heteroatom, semakin kurang aromatik heterosiklik, karena elektron pi tertarik padanya dan konjugasi berkurang. Faktor ini menjelaskan aromatisitas pirol yang lebih tinggi dibandingkan dengan furan. Dalam heterosiklik dengan heteroatom dengan keelektronegatifan yang sama, tetapi di mana satu heteroatom memiliki orbital d, heteroatom yang tidak memiliki orbital d menunjukkan aromatisitas yang lebih besar. Orbital D, menjadi lebih menyebar, memberikan tumpang tindih yang kurang efektif dengan atom karbon dan merusak konjugasi. Faktor ini menjelaskan aromatisitas pirol yang lebih tinggi dibandingkan dengan tiofena.