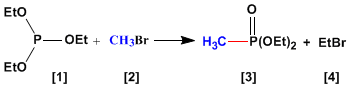RÉACTIONS EN CHIMIE ORGANIQUE
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 13407
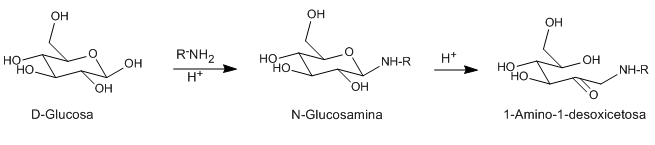
Les acides et les bases catalysent l'isomérisation des N-glycosides (glycosamines) des aldoses aux 1-aminodésoxycétoses. Ce réarrangement peut être catalysé avec un certain nombre d'acides de Lewis (CuCl 2 , MgCl 2 , AlCl 3 , SnCl 4 ). L'amine utilisée comme réactif peut être primaire ou secondaire, aliphatique ou aromatique.
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 12804
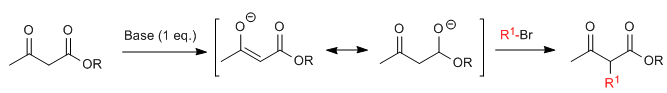
La synthèse acétylacétique permet de préparer des cétones par C-alkylation de l'acétylacétate d'éthyle (3-oxobutanoate d'éthyle).L'acétoacétate d'éthyle peut être déprotoné en position C2 ou C4 selon le type et les quantités de base utilisées.Les hydrogènes en position C2 qu'ils présentent acidité importante (pKa=11) due à la stabilisation de la base conjuguée sur les deux carbonyles voisins. En présence d'un équivalent de base (alkoxydes, LDA, NaHMDS...) un énolate de cétoester capable d'attaquer de nombreux électrophiles carbonés.
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 17211
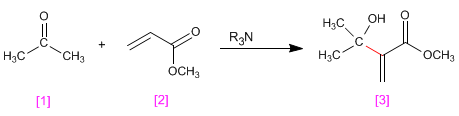
Les aldéhydes et les cétones [1] réagissent avec les composés a,b -insaturés [2] en présence d'amines tertiaires qui agissent comme catalyseurs, pour former des produits a- hydroxyalkylés [3] .
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 16399
La réaction de Barton produit des 4-nitrosoalcools [2] à partir de nitrites [1] par irradiation avec de la lumière ultraviolette.
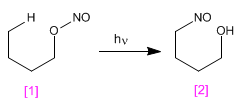
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 23592
Les tosylhydrazones d'aldéhydes ou de cétones [1] réagissent avec deux équivalents d'organolico générant un intermédiaire anionique [2] capable de subir des processus d'alkylation.
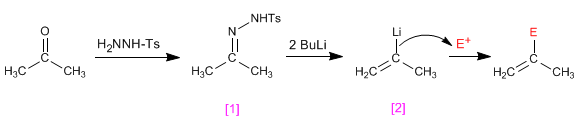
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 19143
L'oxydation Baeyer Villiger permet la transformation des cétones en esters.
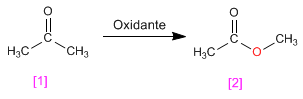
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 20355
La condensation de Claisen implique la réaction d'esters [1] dans un milieu basique pour former des 3-cétoesters [2]
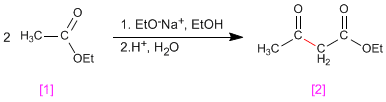
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 27655
Le chlorure d'acétyle [1] est traité avec du diazométhane [2] donnant le sel de diazonium [3] . Le chlorure [4] produit réagit avec le sel de diazonium pour donner l'α-chlorocétone [5] . 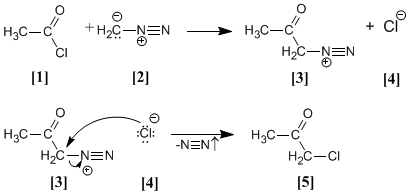
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 18252
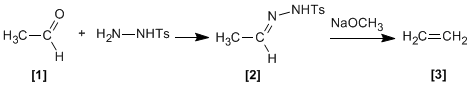
Les tosylhydrazones [2] d'aldéhydes aliphatiques ou de cétones [1] réagissent avec des bases fortes pour donner des alcènes [3] .
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 34262
Dans cette réaction, deux alcènes [1] et [2] sont traités avec un métal de transition qui agit comme un catalyseur, donnant un mélange d'alcènes [3] (y compris les isomères Z/E). Ce produit est obtenu par échange de groupes alkylidène. 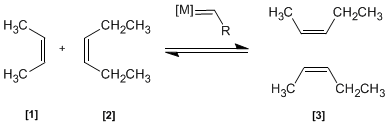
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 29199
La condensation aldol est une réaction d'aldéhydes ou de cétones [1] qui forme des 3-hydroxycarbonyles (aldols) [2] . Le 3-hydroxyaldéhyde [2] dans des conditions de déshydratation par chauffage donne un aldéhyde alpha,bêta-insaturé [3] . 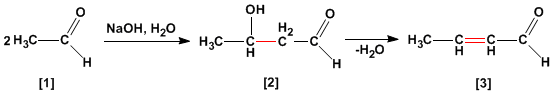
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 25856
La condensation d'acyloïne transforme les esters [1] en alpha-hydroxycétones [2]. Cette réaction est effectuée avec du sodium métallique dans un solvant inerte. 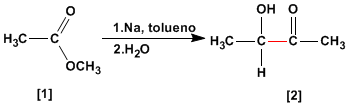
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 23661
La réaction d'Abuzov est utilisée dans la synthèse de phosphonates [3] à partir de phosphites [1] . Les phosphonates obtenus dans la synthèse d'Abuzov sont utilisés comme matières premières dans la synthèse de Horner-Wittig.