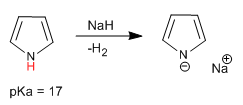
Le pyrrole a un hydrogène acide sur l'atome d'azote avec un pKa = 17. Dans le cas du thiophène et du furane, les hydrogènes acides sont situés en position 2, bien qu'ils aient une acidité beaucoup plus faible que le pyrrole.
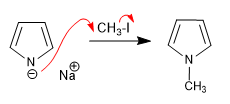
L'anion pyrrolium, formé par la déprotonation du pyrrole, a un caractère ionique important qui lui permet d'agir comme nucléophile contre un groupe diversifié d'électrophiles carbonés.
Alkylation du cation pyrrolium.
Acylation du cation pyrrolium
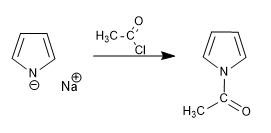
Le caractère ionique de l'ion pyrrolium est lié à la base qui l'a généré. Ainsi, les bases sodiques et potassiques (amides ou hydrures de sodium et de potassium) génèrent de la pyrrolie ionique. Cependant, les organométalliques de lithium et de magnésium ou les amides de lithium produisent des pyrrolia à caractère covalent important qui maintiennent le couple azoté bloqué, produisant l'attaque nucléophile à travers le cycle.
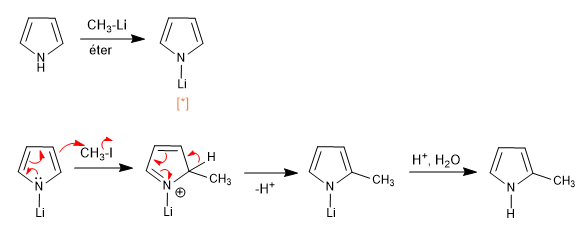
[*] Les pyrrolures de lithium ou de magnésium ont un caractère covalent important, qui bloque la paire d'azote, produisant l'attaque de l'électrophile à travers l'anneau
Le thiophène et le furane manquent d'hydrogènes sur l'hétéroatome, mais on peut soustraire les hydrogènes des positions 2,5 en utilisant des bases fortes (organométalliques)
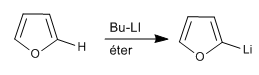
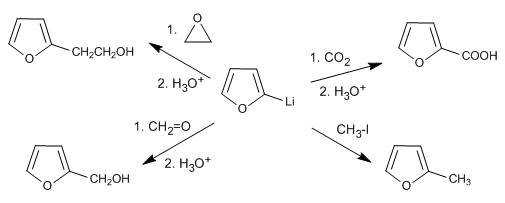
La réaction de l'organolithique avec différents électrophiles permet d'ajouter des chaînes en position 2.
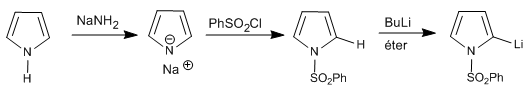
Il est également possible de déprotoner la position 2 d'un pyrrole, tant que l'azote ne contient pas d'hydrogène.
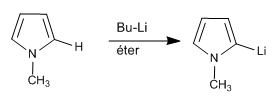
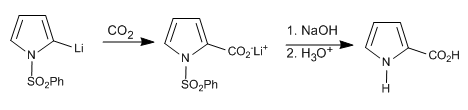
Dans le cas des 1H-pyrroles, les étapes suivantes peuvent être effectuées pour déprotoner la position 2.