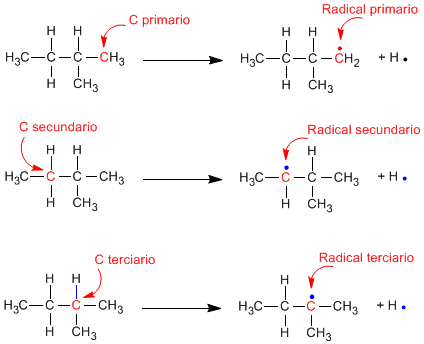
Beim homolytischen Brechen der CH-Bindung eines Alkans entstehen Alkylradikale und freie Wasserstoffatome. Die für diesen Bruch erforderliche Energie wird als Dissoziationsenergie bezeichnet und ist umso geringer, je stabiler das gebildete Radikal ist.
Wie aus den folgenden Reaktionen ersichtlich ist, ist die zum Aufbrechen einer primären CH-Bindung erforderliche Energie viel höher als die zum Aufbrechen einer tertiären CH-Bindung erforderliche Energie.
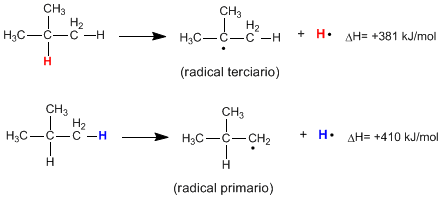
Es wird beobachtet, dass die tertiären Reste stabiler sind als die sekundären und diese wiederum stabiler als die primären.
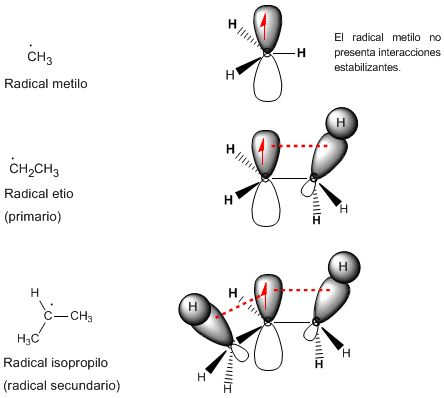
Hyperkonjugation
Das Phänomen, das die Radikale stabilisiert, wird als Hyperkonjugation bezeichnet und besteht aus der Wechselwirkung zwischen der CH-Bindung der Methylgruppe und dem p-Orbital, das das ungepaarte Elektron trägt. Diese Wechselwirkung ermöglicht es dem Elektronenpaar aus dem bindenden Sigma-Orbital, sich in das teilweise besetzte p-Orbital zu verlagern und es zu stabilisieren.