Oxirane wirken als Lewis-Basen, die in sauren Medien an Sauerstoff protonieren. Die zweite Art der Reaktivität hängt mit der Ringspannung zusammen, die Öffnungsreaktionen begünstigt.
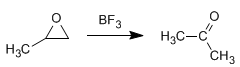
Isomerisierung zu Carbonylverbindungen: Oxirane isomerisieren in Gegenwart von Lewis-Säuren zu Aldehyden oder Ketonen. So wird Oxiran in Gegenwart von BF 3 in Acetaldehyd umgewandelt
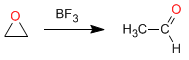
Beispiel: Schlagen Sie einen Mechanismus für die folgende Transformation vor:
Lösung – Das BF 3 protoniert den Sauerstoff des Oxiran, wandelt es in eine gute Abgangsgruppe um und begünstigt die Öffnung des Zyklus. Eine Umlagerung zu einem Hydroxycarbocation ergibt das erwartete Produkt.
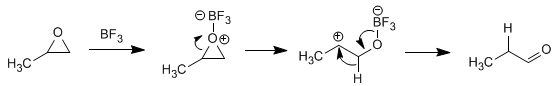
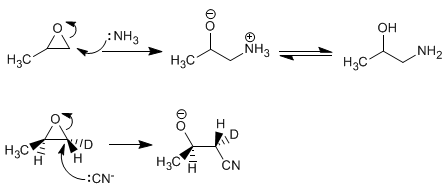
Öffnung von Oxiranen in basischen Medien – Gute Nucleophile greifen an und öffnen Oxirane am am wenigsten substituierten Kohlenstoff. Der Öffnungsmechanismus ist vom S N 2-Typ und beinhaltet den Angriff des Nucleophils von der gegenüberliegenden Seite zu Sauerstoff, der sich als Abgangsgruppe verhält.
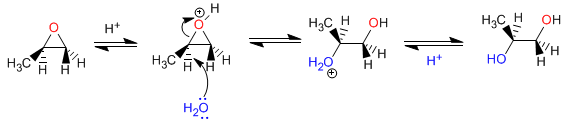
Öffnung von Oxiranen in saurem Medium - In sauren Medien wird Sauerstoff protoniert, was den nukleophilen Angriff auf Kohlenstoff begünstigt. Die Öffnung erfolgt am am stärksten substituierten Kohlenstoff. Mit H + /H 2 O werden Antidiole erhalten.
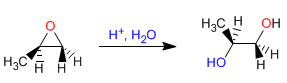
Mechanismus:
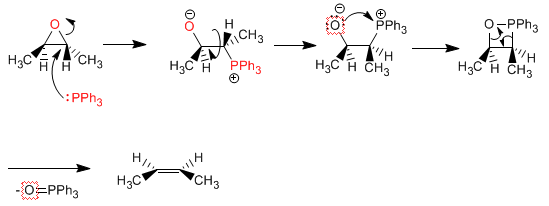
Desoxygenierung von Oxiranen: Oxirane mit trans-Substituenten können in cis-Alkene umgewandelt werden. Wohingegen Oxirane mit cis-Gruppen in trans-Alkene umgewandelt werden. Sehen wir uns ein Beispiel an: