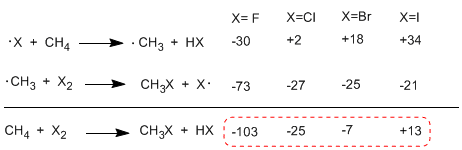При сравнении энтальпий стадий распространения различных галогенов наблюдаются важные различия в обмениваемых теплотах. В случае фтора обе стадии являются экзотермическими (даже выделение водорода) с глобальным энергетическим балансом -103 ккал/моль. Энергии активации переходных состояний в этой реакции очень низкие, что делает его наиболее реакционноспособным галогеном.
На другом полюсе реакционной способности находится йод, реакция которого эндотермическая и не протекает.
Порядок реакционной способности F 2>Cl 2> Br 2> I 2
В следующей таблице показан теплообмен на стадиях распространения галогенирования метана.
Реакция сильно экзотермична в случае фтора (галоген более реакционноспособен), тогда как в случае йода она эндотермична при 13 ккал/моль.