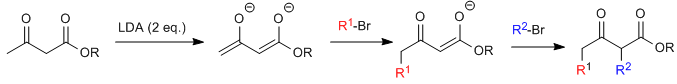
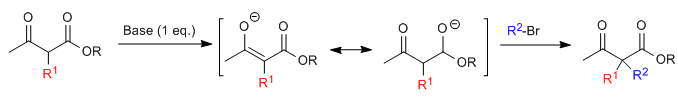
La synthèse acétylacétique permet de préparer des cétones par C-alkylation de l'acétylacétate d'éthyle (3-oxobutanoate d'éthyle).L'acétoacétate d'éthyle peut être déprotoné en position C2 ou C4 selon le type et les quantités de base utilisées.Les hydrogènes en position C2 qu'ils présentent acidité importante (pKa=11) due à la stabilisation de la base conjuguée sur les deux carbonyles voisins. En présence d'un équivalent de base (alkoxydes, LDA, NaHMDS...) un énolate de cétoester capable d'attaquer de nombreux électrophiles carbonés.
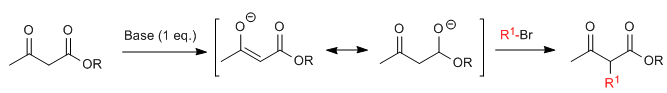
Où R 1 est un groupe alkyle primaire ou secondaire, allyle ou benzyle.
Le substrat monoalkylé est susceptible d'une seconde alkylation par ajout d'un second équivalent de base suivi de l'électrophile.
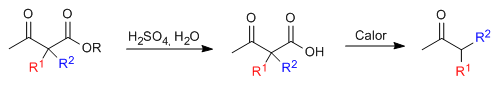
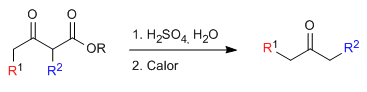
Le cétoester monoalkylé ou dialkylé est ensuite soumis à une étape d'hydrolyse acide qui le transforme en un cétoacide sensible à la décarboxylation par chauffage.