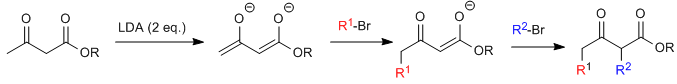
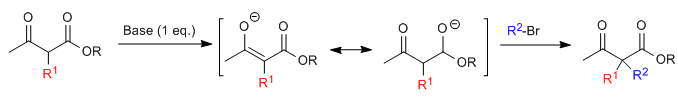
Die Acetylessigsäuresynthese ermöglicht die Herstellung von Ketonen durch C-Alkylierung von Ethylacetylacetat (Ethyl-3-oxobutanoat).Ethylacetoacetat kann je nach Art und Menge der verwendeten Base an den C2- oder C4-Positionen deprotoniert werden. Die Wasserstoffatome an der C2-Position sind vorhanden deutliche Acidität (pKa=11) aufgrund der Stabilisierung der konjugierten Base an den beiden benachbarten Carbonylgruppen. In Gegenwart eines Basenäquivalents (Alkoxide, LDA, NaHMDS usw.) ein Ketoesterenolat, das zahlreiche carbonisierte Elektrophile angreifen kann.
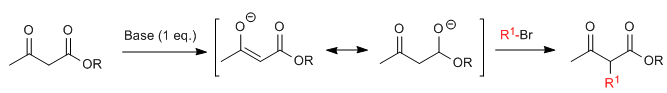
Wobei R 1 eine primäre oder sekundäre Alkyl-, Allyl- oder Benzylgruppe ist.
Das monoalkylierte Substrat ist einer zweiten Alkylierung zugänglich, indem ein zweites Äquivalent einer Base gefolgt von dem Elektrophil zugegeben wird.
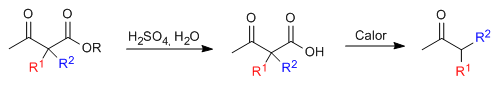
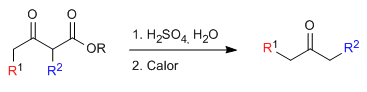
Der monoalkylierte oder dialkylierte Ketoester wird dann einem Säurehydrolyseschritt unterzogen, der ihn in eine durch Erhitzen decarboxylierungsempfindliche Ketosäure umwandelt.