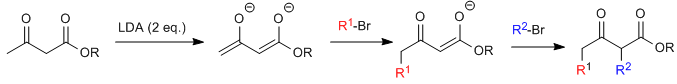
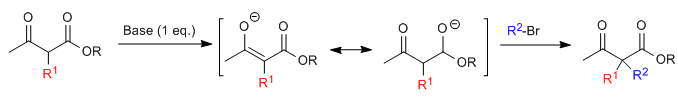
Синтез ацетилуксусной кислоты позволяет получать кетоны путем С-алкилирования этилацетилацетата (этил-3-оксобутаноата). Этилацетоацетат может быть депротонирован в положениях С2 или С4 в зависимости от типа и количества используемого основания. Водороды в положении С2, которые они представляют значительная кислотность (pKa = 11) из-за стабилизации сопряженного основания на двух соседних карбонилах. В присутствии эквивалента основания (алкоксиды, LDA, NaHMDS и т. д.) енолят кетоэфира способен атаковать многочисленные карбонатные электрофилы.
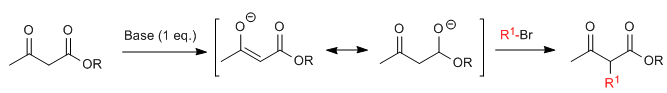
Где R 1 представляет собой первичную или вторичную алкильную, аллильную или бензильную группу.
Моноалкилированный субстрат поддается второму алкилированию путем добавления второго эквивалента основания, а затем электрофила.
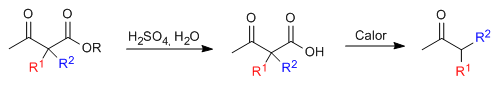
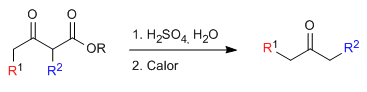
Моноалкилированный или диалкилированный кетоэфир затем подвергают кислотному гидролизу, который превращает его в кетокислоту, чувствительную к декарбоксилированию при нагревании.