THÉORIE DES GLUCIDES
- Détails
- Germán Fernández
- THÉORIE DES GLUCIDES
- Affichages : 2628
Les glucides les plus simples sont des sucres ou des saccharides, ce sont des aldéhydes polyhydroxylés ou des cétones. Ils sont classés en aldoses s'ils possèdent la fonction aldéhyde et en cétoses s'ils possèdent la fonction cétone.
Les aldoses sont classés selon le nombre de carbones dans : les aldotrioses, les aldotétroses, les aldopentoses et les aldohexoses.
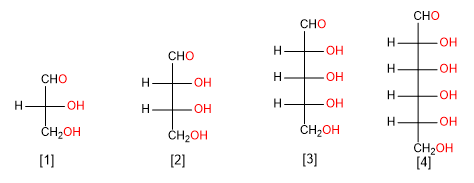
[1] Aldose de trois atomes de carbone (aldotriose)
[2] Aldose de quatre atomes de carbone (aldotétrose)
[3] Aldose de cinq atomes de carbone (aldopentose)
[4] Aldose à six atomes de carbone (aldohexose)
- Détails
- Germán Fernández
- THÉORIE DES GLUCIDES
- Affichages : 35697
Le tableau suivant compile les monosaccharides naturels qui contiennent un groupe aldéhyde, appelés aldoses. Le tableau est construit à partir du plus petit aldose, le glycéraldéhyde (aldotriose). L'érythrose et le thréose (aldotétroses) sont obtenus à partir du glycéraldéhyde en ajoutant un quatrième carbone. L'ajout d'un cinquième carbone aux aldotétroses donne naissance aux aldopentoses, qui à leur tour forment les aldohexoses en ajoutant un sixième carbone.
- Détails
- Germán Fernández
- THÉORIE DES GLUCIDES
- Affichages : 21135
Les cétoses naturels sont une famille de monosaccharides qui contiennent un groupe cétone en position 2 de la chaîne.
- Détails
- Germán Fernández
- THÉORIE DES GLUCIDES
- Affichages : 40787
Lors de l'étude de la rotation optique du glycéraldéhyde naturel, il a été observé qu'il coïncidait avec l'énantiomère dextrogyre et il a été nommé D-glycéraldéhyde. L'énantiomère lévogyre, non présent dans la nature, a été nommé L-glycéraldéhyde.
- Détails
- Germán Fernández
- THÉORIE DES GLUCIDES
- Affichages : 34454
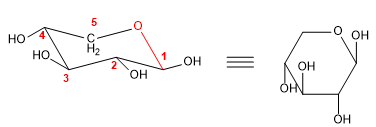
La projection de Haworth permet de dessiner les formes de l'hémiacétal dans le plan. Dans le cas des furanoses, nous avons déjà utilisé cette notation dans les exemples précédents, je vais donc dessiner un exemple de pyranose dans cette projection.
- Détails
- Germán Fernández
- THÉORIE DES GLUCIDES
- Affichages : 30970
Les sucres en solution se trouvent le plus souvent sous une forme cyclique, appelée hémiacétal. L'hémiacétal est obtenu en attaquant l'un des groupements hydroxyle de la chaîne sur le carbonyle. Les cycles formés sont de cinq ou six membres.
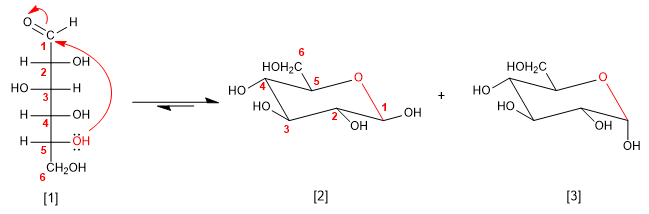
[1 ] D-Glucose
[2] b -D-Glucopyranose
[3] a -D-Glucopyranose
- Détails
- Germán Fernández
- THÉORIE DES GLUCIDES
- Affichages : 20135
La mutarotation est l'interconversion entre anomères via la forme ouverte. Ainsi, le glucose se retrouve dans le milieu aqueux sous la forme d'un mélange d'anomères alpha et bêta et d'une faible quantité sous forme ouverte. Regardons cet équilibre.
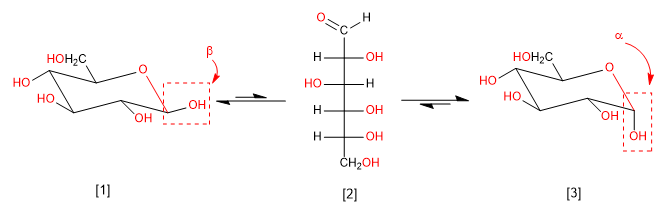
[1] b -D-Glucopyranose (63,6 %)
[2 ] D-Glucose (0,003 %)
[3] a -D-Glucopyranose (36,4 %)
- Détails
- Germán Fernández
- THÉORIE DES GLUCIDES
- Affichages : 26547
La synthèse Kiliani-Fischer permet d'allonger la chaîne monosaccharidique par la formation et la réduction ultérieure de cyanohydrines. Le gros problème de la synthèse est le manque de stéréosélectivité.
- Détails
- Germán Fernández
- THÉORIE DES GLUCIDES
- Affichages : 15378
Cu(II) et Ag(I) sont capables d'oxyder sélectivement le groupe carbonyle des aldoses en acide carboxylique, générant des précipités de Cu 2 O et d'Ag élémentaire.
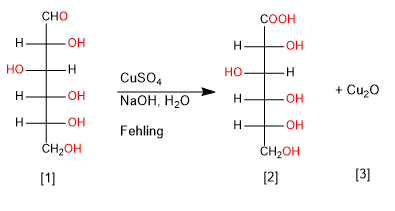
[1 ] D-Glucose
[2] Acide D-Gluconique
[3] Oxyde cuivreux précipité