SYNTHESE ORGANIQUE
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 25505
SYNTHESE D'HETEROCYCLES PAR CYCLATION INTRAMOLECULAIRE
La construction de systèmes hétérocycliques utilise également ces mêmes réactions, avec la particularité que le système hétérocyclique doit être présent ou contenir au moins un atome autre que le carbone. Les plus courants sont l'azote, l'oxygène, le soufre et le phosphore.
Le système cyclique de la molécule à synthétiser peut provenir de la modification d'un système cyclique présent dans l'un des réactifs impliqués dans la synthèse ou être le résultat d'une cyclisation d'antécédents non cycliques et qui a été construit dans le développement de la synthèse par cyclisation intramoléculaire ou par des méthodes basées sur des cyclisations intermoléculaires (cycloadditions).
1. Cyclisation intramoléculaire
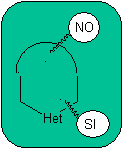
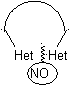
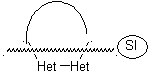
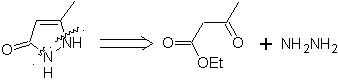
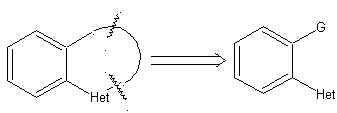
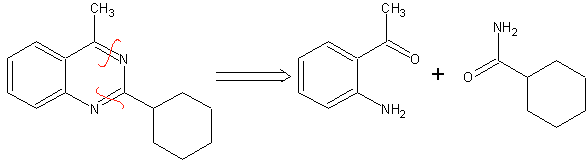
Les règles générales de déconnexion des hétérocycles issus d'une cyclisation intramoléculaire, ont été adéquatement systématisées par JI Borrell , les mêmes que ceux supposés dans cette section (Het = N, O, S)
1. Dans la synthèse d'un composé monocyclique, la cyclisation implique généralement la formation d'une liaison carbone-hétéroatome.
|
Modèle:
|
|
|
Exemple: |
|
|
|
|
|
|
Exemple :
|
|
|
Modèle:
|
|
|
Exemple:
|
|
Lire la suite : Synthèse d'hétérocycles par cyclisation intramoléculaire
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 22311
Mob : 75 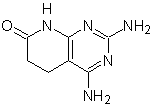 |
Mob : 76 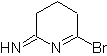 |
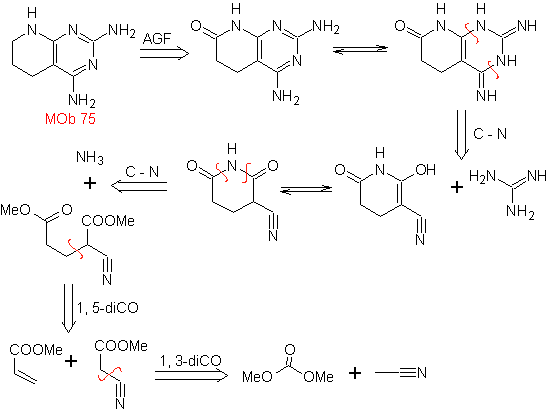
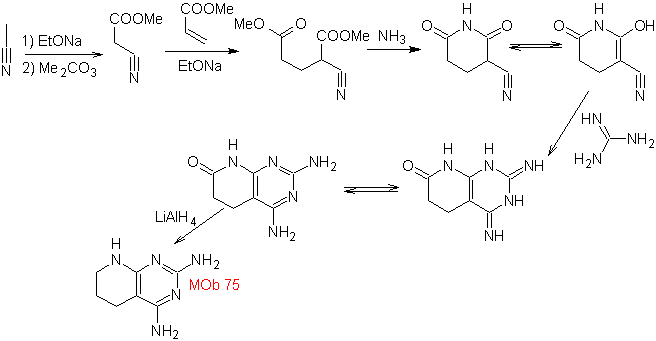
<!--[if !vml]--><!--[endif]-->
Lire la suite : Le groupe cyano dans la synthèse des hétérocycles
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 26655
Synthèse d'hétérocycles à plusieurs hétéroatomes
Les composés hétérocycliques, comme déjà mentionné, ont une large gamme d'applications : ils prédominent parmi les composés utilisés comme produits pharmaceutiques, agrochimiques et à usage vétérinaire ; ils sont utilisés comme additifs de polissage, antioxydants, inhibiteurs de corrosion, comme colorants et pigments ; et dans de nombreuses autres applications.
Par conséquent, il est raisonnable qu'actuellement une grande partie de la recherche en chimie porte sur la synthèse et les propriétés des composés hétérocycliques. À cette fin, cet article est orienté, qui vise à fournir aux étudiants en chimie les outils de base de la rétrosynthèse.
Le processus de déconnexion des molécules à plusieurs hétéroatomes peut être réalisé pour chaque liaison carbone-hétéroatome, selon les modèles précédemment étudiés ou simultanément, pour lesquels des réactifs polyhétéroatomes abordables sont utilisés.
1. Hétéroatomes de distance (1, 2)
Les réactifs les plus représentatifs et usuels sont les hydrazines et les hydrazines substituées, ainsi que les hydroxylamines.
|
hydrazine |
hydroxylamine |
Proposer un design de synthèse, à partir de matériaux simples, pour les molécules suivantes :
|
|
foule 77
pyrazoles |
|
Mob 78
isoxazoles |
|
Mob 79
pyridazines |
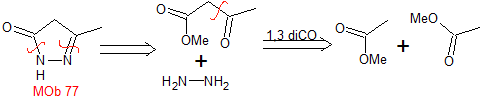
MOb 77 . Analyse rétrosynthétique. MOb est un dérivé du pyrazole et est directement déconnecté par des liaisons CN, pour générer des précurseurs simples tels que l'hydrazine et un composé 1,3-diCO.
|
|
|
synthèse . L'acétate de méthyle est un bon précurseur pour former le composé 1,3-diCO, qui se combine avec l'hydrazine pour générer MOb 77. |
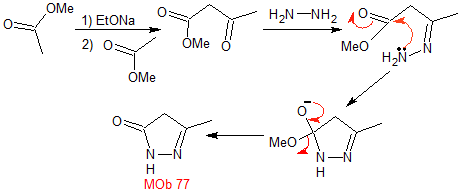
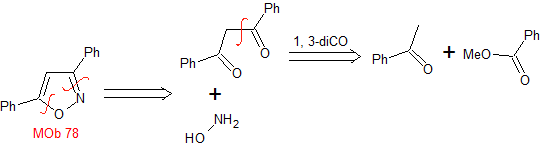
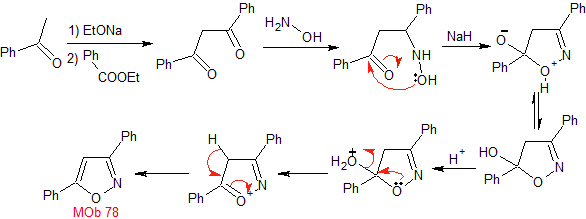
MOb 78- Analyse rétrosynthétique .
|
|
La synthèse. La bézophénone et le benzoate d'éthyle permettent de former le 1,3-diCO recherché, de réagir en milieu légèrement acide avec l'hydroxylamine et après ajout de NaH, il se produit une cyclisation qui nécessite plus d'acide pour déshydrater et finalement produire
|
|
Lire la suite : Synthèse d'hétérocycles à plusieurs hétéroatomes
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 20735
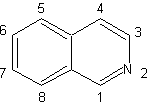
Synthèse d'isoquinoline
(Par la méthode des déconnexions)
|
|
Les isoquinoléines diffèrent structurellement des quinoléines dans la position l'azote, puisque ce dernier n'est pas fusionné, il présente donc une "réactivité aliphatique". On ne le trouve pas libre dans la nature, mais le cycle de l'isoquinoléine se retrouve dans certains alcaloïdes, sous forme aromatique ou réduite, par exemple la papavérine. |
Les méthodes de synthèse les plus connues pour la préparation des isoquinoléines partent des 2-phényléthylamines et impliquent une cyclisation par un carbone supplémentaire fourni par le groupe carbonyle d'un autre composé.
Les principales méthodes de synthèse sont : la synthèse Pomeranz-Fritsch, la synthèse Bischler-Napieralski, la synthèse Pictet-Gams et la synthèse Pictet-Spengler.
1. Synthèse de POMERANZ-FRITSCH.
Cette méthode de synthèse de l'isoquinoline se déroule en deux étapes :
pour. Tout d'abord, le benzaldéhyde (1,3-électrophile-nucléophile) est condensé avec le diéthylacétal d'aminoacétaldéhyde (1,3-nucléophile-électrophile) pour former une aldimine stable.
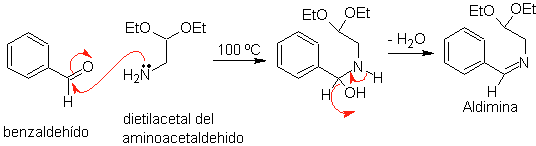
b. Par la suite, l'aldimine se cyclise en milieu acide fort, en imine, avec élimination simultanée d'éthanol, pour donner une isoquinoline.
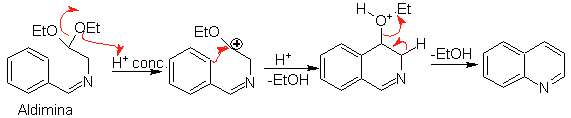
Cette deuxième étape, étant une substitution électrophile, est soumise à l'effet que les substituants donneurs ou accepteurs d'électrons ont sur le cycle benzénique dans ladite réaction. Cependant, du fait de l'hydrolyse de l'imine formée, dans le milieu acide fort utilisé dans la réaction, le rendement du procédé est réduit.
Cette méthode permet d'accéder aux isoquinoléines substituées en C-1, pour lesquelles des cétones aromatiques ont été testées, avec des rendements très faibles. Cependant, il y a eu un plus grand succès en utilisant la variante des benzylamines substituées de manière appropriée comme 1,4-dinucléophiles et du diéthylacétal de glyoxal comme 1,2-diélectrophiles.
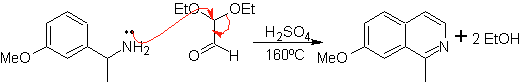
Ce qu'il faut préciser, c'est que la méthode Pomeranz-Fritsch et sa variante, précédemment analysée, ne permettent pas la préparation d'isoquinoléines substituées en C-3 et C-4 de l'hétéroatome. L'analyse rétrosynthétique de cette méthode montre les éventuels intermédiaires impliqués dans la réaction et les matières premières probables.
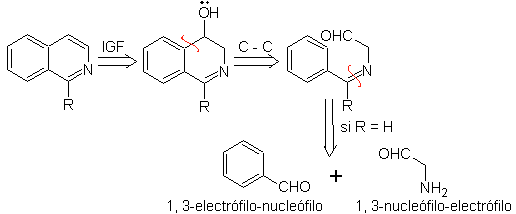
|
Proposer un design de synthèse pour chacune des isoquinoléines suivantes :
|
Mob 107
|
|
Mob 108
|
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 16911
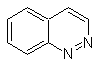
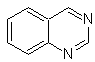
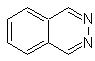
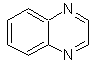
Synthèse des BENZODIAZINES
(Par la méthode des déconnexions)
Les structures des benzodiazines se trouvent dans de nombreux alcaloïdes, principalement sous la forme d'un système cyclique de quinazolone. Les autres dérivés de la benzodiazine, tels que les cinnolines, les quinoxalines et les phtalizines, constituent également une part importante de nombreux médicaments au spectre d'utilisation important, ce qui les rend, en général, très importants en synthèse organique et particulièrement en pharmacochimie. Ainsi, on les retrouve comme anti-inflammatoires, antihypertenseurs, antibactériens, antalgiques, antibiotiques, etc.
|
cinnoline |
|
quinazoline |
|
phtalizine |
|
Quinoxaline |
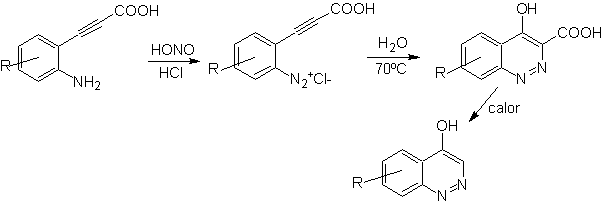
Synthèse des Cinnolines
Selon la structure que présente la cinnoline, il existe les options suivantes pour sa synthèse :
![]() synthèse de von Richter :
synthèse de von Richter :
![]() Synthèse Widman-Stoermer :
Synthèse Widman-Stoermer :
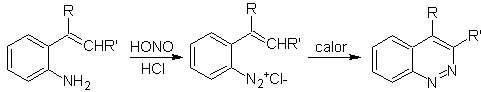
|
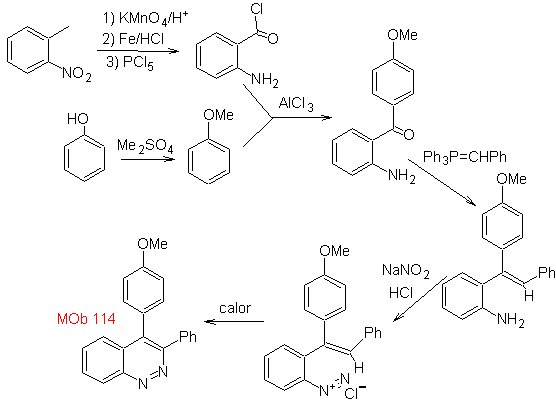
Proposer un plan de synthèse pour la molécule suivante :
|
Ob 114
|
Mob 114 . Analyse rétrosynthétique.
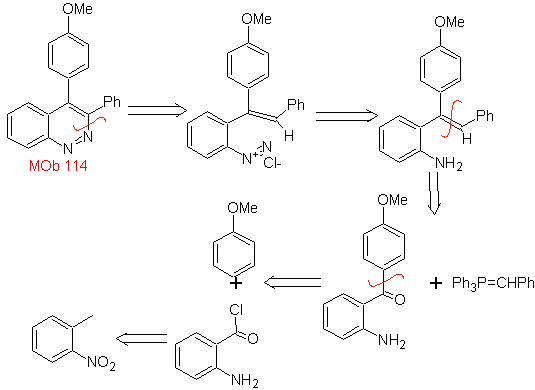
Synthèse La formation de
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 64443
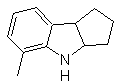
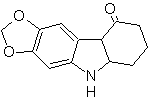
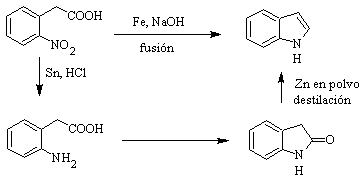
Synthèse des INDOLES
(Par la méthode des déconnexions)
Le système cyclique indole a été trouvé dans de nombreux composés naturels d'un grand intérêt chimique et biochimique, c'est pourquoi on dit qu'il est le plus abondant dans la nature. Ainsi, le tryptophane est un acide aminé essentiel, l'indigo est un colorant et l'acide indolyl-3-acétique est une hormone de croissance végétale. D'autre part, l'intérêt de ces molécules vient de leur utilisation pharmacologique, comme par exemple le sumatriptan (antimigraineux) et le frovatriptan, également antimigraineux.
L'indole est un solide cristallin incolore avec un PF de 52°C, facilement soluble dans la plupart des solvants organiques et cristallise à partir de l'eau, a une odeur agréable et est donc également utilisé comme base de parfum.
Il a été préparé pour la première fois en 1866 en chauffant de l'oxindole avec de la poussière de zinc et est devenu un produit commercial important. Baeyer en 1869 proposa la synthèse suivante :
Les méthodes classiques de synthèse des indoles sont celles de Fischer, Bischler, Reissert et Leimgruber-Batcho, Bartoli, Larock, Gassman, Sugasawa, Fukuyama, Hegedus et Dobbs.
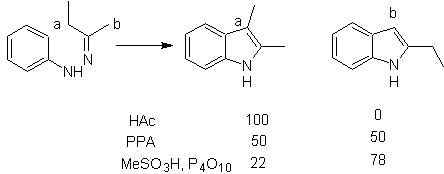
1. Synthèse FISCHER
Il consiste à chauffer des phénylhydrazones de cétones ou d'aldéhydes, avec du chlorure de zinc anhydre, du trifluorure de bore, de l'acide polyphosphorique ou un autre catalyseur acide, pour produire des indoles. Un réarrangement catalysé par un acide d'une phénylhydrazone se produit avec élimination de l'eau et du NH 3 . Les groupes électrodonneurs favorisent la cyclisation et les électroattracteurs l'empêchent.
Avec les cétones asymétriques, la cyclisation intramoléculaire de l'hydrazone peut conduire à deux indoles isomères dans des proportions différentes selon les conditions utilisées ; en milieu fortement acide, l'indole le moins substitué peut prédominer.
Lorsqu'il y a des substituants méta, par rapport à l'azote de l'hydrazone, la cyclisation peut avoir lieu en deux positions, conduisant à deux indoles isomères :
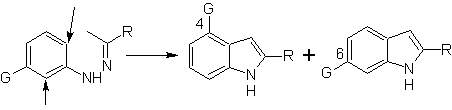
Si le substituant G est électro-attracteur, les deux isomères (4- et 6-) se forment à peu près dans la même proportion. En revanche, si G est un substituant donneur d'électrons, il se forme principalement l'isomère substitué en 6. L'analyse rétrosynthétique de l'indole formé par la synthèse de Fischer peut être considérée comme suit :
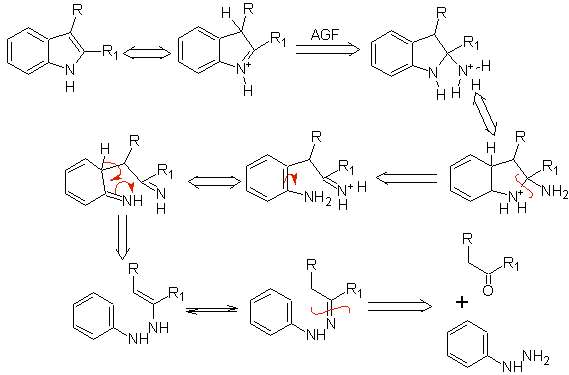
|
Proposer un plan de synthèse pour les molécules suivantes :
|
Mob 119
|
|
Mob 120
|
MOb 119. Analyse rétrosynthétique. La déconnexion fondamentale dans les indoles supposés être formés par la synthèse de Fischer correspond à une rétro-transposition, qui se traduit par la déconnexion de
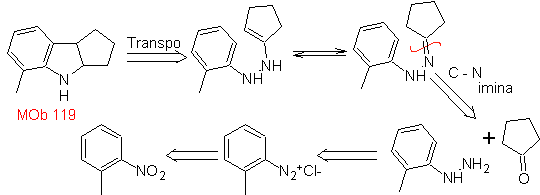
Synthèse : A partir d'ortho-nitrotoluène, on génère le dérivé intermédiaire de la phénylhydrazine, nécessaire à la synthèse des indoles de Fischer, on forme l'imine avec une cyclopentanone, et en chauffant
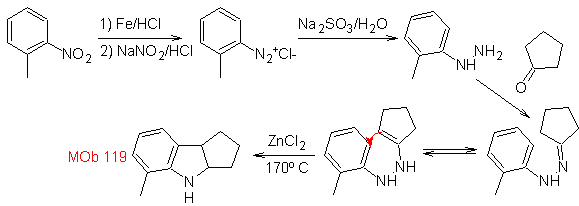
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 21759
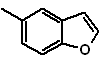
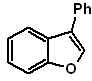
Synthèse de Benzofuranes et Benzothiophènes
(Par la méthode des déconnexions)
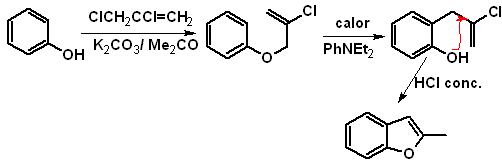
1. Synthèse des benzofuranes
Benzofuran, généralement appelé coumarone, C'est un liquide incolore, qui est isolé du goudron de houille et qui est beaucoup plus stable aux attaques chimiques que le furane.
Les synthèses les plus classiques pour la préparation des benzofurannes seront évoquées et développées :
pour. De la coumarine
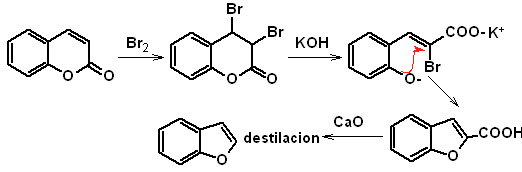
b. D'une réaction de condensation interne de Claisen
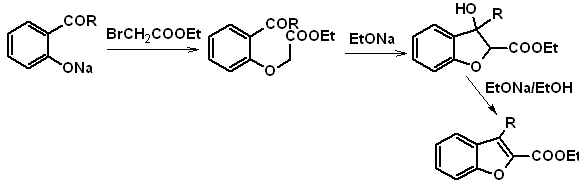
c. À partir d'un réarrangement de Claisen
Proposer un design de synthèse, pour les benzofuranes suivants :
|
: |
Mob 127
|
… |
Mob 128
|
MOb 127, Analyse rétrosynthétique. La stratégie de désengagement, en
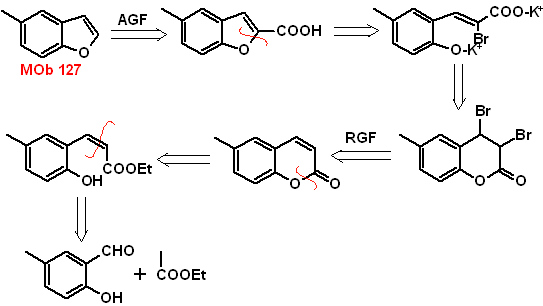
La synthèse. L'intermédiaire 2-hydroxy-5-méthylbenzaldéhyde est préparé à partir de benzène. Le dérivé de coumarine qui se forme est halogéné, hydrolysé dans un sol de KOH puis chauffé avec du CaO, pour se décarboxyler et former ainsi
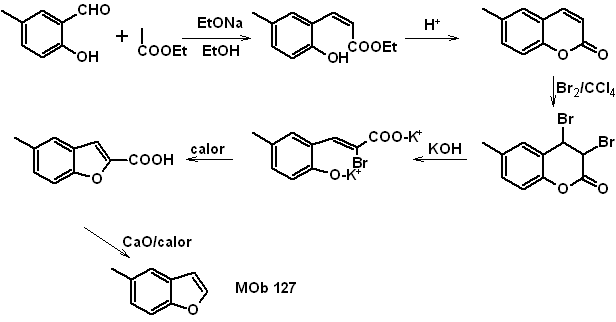
Lire la suite : Synthèse de benzofuranes et de benzothiophènes
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 48326
SYNTHÈSE DE SULFAMIDE
On sait que les sulfamides ont été les premiers antimicrobiens à être utilisés par voie systémique. Sa structure chimique est un noyau benzénique avec des groupements amino qui lui confèrent son activité. Le groupe amino est acétylé dans le foie, l'inactivant. Selon le substituant dans ledit secteur, le médicament est plus actif.
Compte tenu de sa similitude avec l'acide para-aminobenzoïque, il se comporte comme un inhibiteur compétitif de cette substance, qui est nécessaire avec la dihydroptéridine pour synthétiser l'acide dihydrofolique, un composé intermédiaire dans la voie de synthèse des folates.
Contrairement aux organismes plus avancés, les bactéries ont besoin de synthétiser leurs propres folates [elles ne les acquièrent pas de l'environnement], donc les sulfamides, en inhibant ce processus, inhibent les processus de synthèse des acides nucléiques et sont BACTÉRIOSTATIQUES.
|
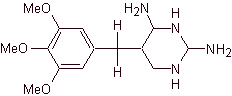
TRIMETROPRIM
Le triméthoprime est un dérivé des 2,4 diaminopyrimidines telles que |
Ce composé INHIBE l'enzyme dihydrofolate réductase et empêche la formation d'acide tétrahydrofolique, c'est-à-dire qu'ils agissent dans la même voie métabolique que les sulfamides, mais dans une réaction enzymatique ultérieure. Le triméthoprime n'est jamais utilisé seul, mais lorsqu'il est associé à des sulfamides, il est potentialisé de telle manière qu'il devient BACTÉRICIDE, diminue la possibilité de générer des résistances et augmente le spectre antimicrobien. L'association entre sulfaméthoxazole et triméthoprime est fixe : 1:5. Par exemple, les préparations commerciales Cotrimoxazole [forte ou non] viennent avec cette raison. |
Sulfamides, ils sont généralement classés en fonction de la durée de leur action et de la manière dont le médicament est appliqué, ainsi que d'autres caractéristiques. Selon le mode d'action, les sulfamides peuvent être :
pour) Sulfamides à action courte ou intermédiaire.
pour. Sulfamides à usage général
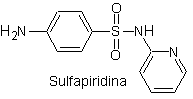
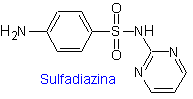
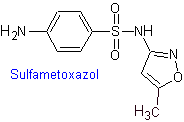
Yo. Sulfathiazole
ii. sulfadiazine
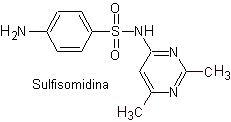
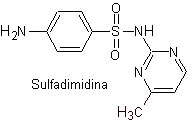
iii. Sulfadimidine
iv. Sulfaméthoxazole (seul ou associé au triméthoprime : cotrimoxazole)
b. Composés très solubles initialement utilisés dans le traitement des infections des voies urinaires.
Yo. Sulfisoxazole
ii. sulfaméthizole
iii. Sulfasomidine
b) Sulfamides à action prolongée.
iv. sulfaméthoxypyridazine
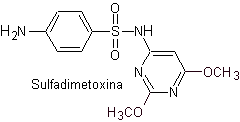
v. sulfadiméthoxine
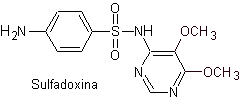
scie. Sulfadoxine
c) Sulfamides limités au tractus gastro-intestinal
vii. Sulfaguanidine
viii. Sulfatalidine
ix. Sulfasuxidine
X. Sulfazolazine
d) Sulfamides topiques.
xi. acétate de mafénide
xii. sulfadiazine d'argent
xiii. sul facetamide sodique
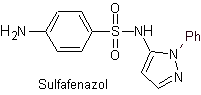
Principaux sulfas :
|
|
……… |
|
|
|
|
|
|
|
…….. |
|
|
|
|
|
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 25453
Synthèse des antibiotiques Fluoroquinolones
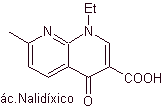
Les quinolones appartiennent à un groupe d'agents antibactériens synthétiques. L'agent le plus ancien de cette famille, l'acide nalidixique, utilisé au début des années 1960, possède un bon spectre contre les entérobactéries (spectre antibactérien limité) mais sa pharmacocinétique n'est pas très favorable pour une utilisation clinique de routine en raison de sa faible biodisponibilité dans les tissus et de sa courte moitié -vie.
Pour cette raison, il était nécessaire de synthétiser de nouveaux antibactériens de cette famille pour améliorer le spectre d'activité, le profil pharmacocinétique, réduire les effets indésirables et l'apparition de résistances bactériennes. Ce nouveau groupe sont les soi-disant fluoroquinolones, générés au cours des années 80.
|
|
De nombreux chercheurs s'accordent à dire que la réaction de Gould-Jacobs , est la base principale de la synthèse des premières quinolones à usage pharmacologique, survenue dans les années 1960, cette réaction présente la séquence suivante :
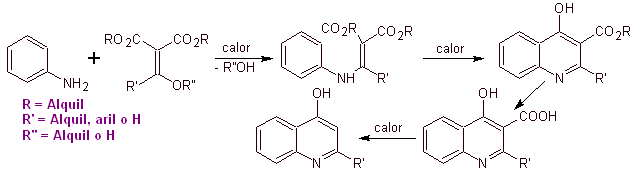
Dans les années suivantes, le fluor en position 6 et divers groupes d'hétérocycles en position 7 ont été introduits dans le cycle basique des benzoquinolones, donnant naissance à des fluoroquinolones à plus grand spectre antibactérien.
Des parties importantes des méthodologies utilisées dans ces synthèses ont été compilées par Leyva S et Leyva E très bon travail d'un point de vue biochimique.
La méthode de déconnexion appliquée au rapport des synthèses étudiées et les réactions des premières étapes des synthèses relèvent de la seule responsabilité de l'auteur de cette monographie. .
i) Synthèse rapportée par Koga H. et al.
Analyse rétrosynthétique :
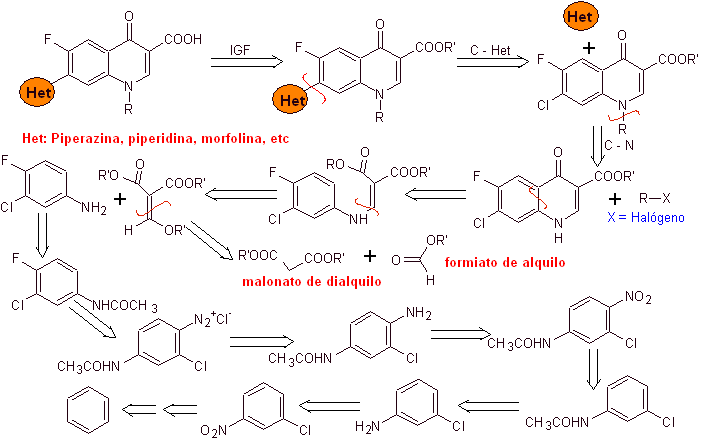
Synthèse : Il part du benzène pour former la 3-chloro-4-fluoroaniline, qui réagit avec le diéthyl EMME pour produire l'acrylate correspondant, qui lors du chauffage forme un composé cyclique. Ce composé est à son tour mis à réagir avec un agent alkylant puis le composé hétérocyclique azoté est introduit, pour finalement hydrolyser et obtenir la molécule cible.
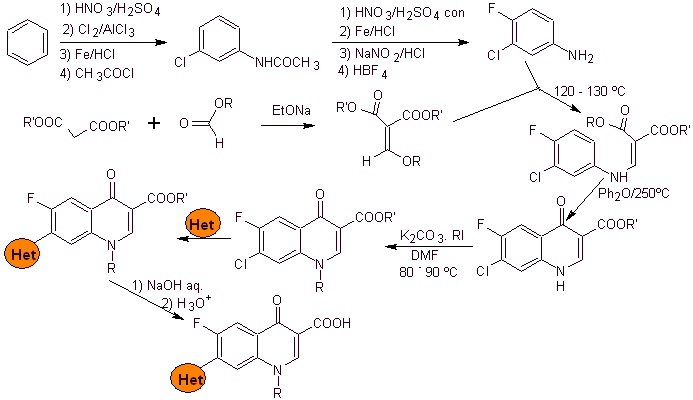
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 37787
Synthèse d'anesthésiques locaux dérivés de l'acide benzoïque
|
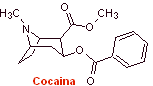
Les propriétés des alcaloïdes isolés des feuilles de la plante de coca ont été découvertes pour la première fois par Gaediche en 1855, la purification et l'isolement du principe actif appelé cocaïne par Albert Nieman en 1860, ont pratiquement commencé l'histoire des anesthésiques locaux. . Par la suite, Einhorn a introduit la procaïne (novocaïne) comme anesthésique local en médecine en 1904. |
|
Depuis, l'humanité a assisté à un développement continu et soutenu de la synthèse de nouvelles molécules aux principes actifs anesthésiques :
![]() En 1925, Niescher a synthétisé la nupercaïne.
En 1925, Niescher a synthétisé la nupercaïne.
![]() En 1928 Von Eisleb tétracaïne (pantocaïne) et
En 1928 Von Eisleb tétracaïne (pantocaïne) et
![]() En 1946, Lofgren et Lundquist ont synthétisé la lognicaïne (xylocaïne ou lidocaïne).
En 1946, Lofgren et Lundquist ont synthétisé la lognicaïne (xylocaïne ou lidocaïne).
![]() Puis en 1954 Af Ekenstam et Egner obtiennent la synthèse de la mépivacaïne (scandicaine).
Puis en 1954 Af Ekenstam et Egner obtiennent la synthèse de la mépivacaïne (scandicaine).
![]() Plus tard en 1960 et 1964, ils ont été introduits dans
Plus tard en 1960 et 1964, ils ont été introduits dans
![]() Enfin, dans les années suivantes, de nouveaux anesthésiques ont été intégrés à la médecine.
Enfin, dans les années suivantes, de nouveaux anesthésiques ont été intégrés à la médecine.
Les anesthésiques locaux sont des médicaments qui, lorsqu'ils sont appliqués sur une zone spécifique du corps, produisent une perte de sensibilité temporaire et réversible (thermique, douloureuse et tactile), sans inhibition de la conscience du patient. La durée de l'effet du médicament dépend de la dose utilisée, de sa structure chimique, de la formulation et de la forme pharmaceutique du médicament.
En général, les médicaments anesthésiques locaux répondent à différentes structures chimiques, mais tous ont des effets similaires ou des intensités différentes de l'effet anesthésique. Cependant, on peut tenter de les regrouper en esters d'acide benzoïque, esters d'acide aminobenzoïque, amides, etc.
1 . Structure chimique des anesthésiques locaux
Les anesthésiques locaux sont principalement des bases faibles et sont formés par un groupe arène, ester ou amide, qui confère à la molécule des propriétés lipophiles (qui déterminent principalement la puissance du médicament), un groupe amino tertiaire aliphatique (alkyle ou alicyclique), qui confère à la molécule son caractère hydrophile, et une chaîne intermédiaire alkyle qui relie les parties de l'arène avec l'amine et est responsable du niveau de toxicité de la drogue.
Ainsi, les principaux anesthésiques locaux utilisés dans les différentes disciplines médicales se retrouvent dans les groupes suivants :
pour) Esters aminés de l'acide benzoïque :
b) Esters d'acide m-aminobenzoïque :
c) Esters d'acide p-aminobenzoïque :
d) Amides :
et) Cétones :
F) autres groupes
2 . Synthèse d'anesthésiques locaux dérivés d'esters aminés de l'acide benzoïque
Les drogues les plus représentatives de ce groupe sont la cocaïne, l'hexylcaïne, la pipérocaïne, l'aminobenzoate d'éthyle, la méprilcaïne, l'amylocaïne, la cyclométhicaïne et la propanocaïne. Ces noms répondent
Lire la suite : Synthèse d'anesthésiques locaux dérivés de l'acide benzoïque
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 37894
Synthèse d'anesthésiques locaux dérivés de l'acide aminobenzoïque
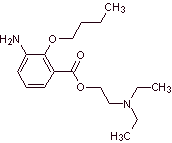
Anesthésiques locaux dérivés de l'acide m-aminobenzoïque
Les médicaments les plus représentatifs de ce groupe sont
|
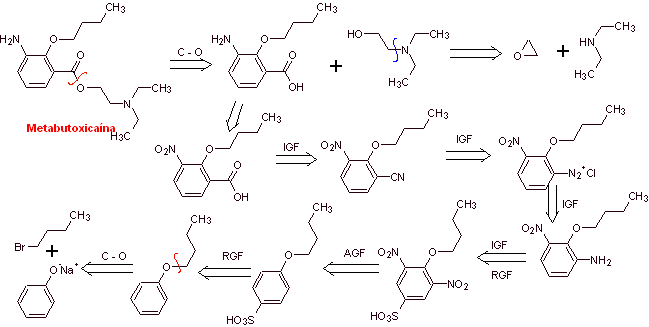
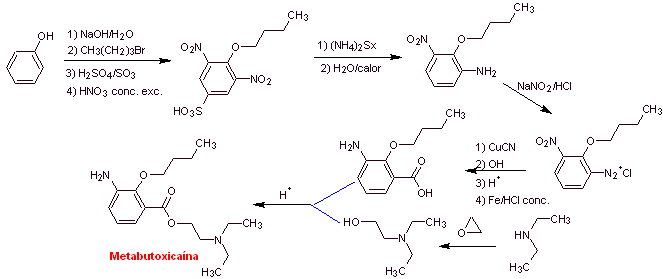
MOb 07 : La métabutoxycaïne , commercialisée sous le nom de primacaïne , est un autre anesthésique local utilisé en dentisterie. Proposer un design de synthèse pour ce médicament, à partir de matériaux simples et abordables.
|
|
Analyse rétrosynthétique : Le clivage acyl-oxygène génère un aminoalcool clivable en amine secondaire et époxyde ; l'autre précurseur invite à préparer son groupement carboxyle par hydrolyse d'un groupement nitrile, qui sera placé sur le cycle benzénique par la réaction de Sandmeyer . La réduction sélective d'un seul des groupements nitro est réalisée avec du polysulfure d'ammonium ou encore avec du Na 2 S.
Synthèse de
|
MOb 08 : La proximéthacaïne (DCI) ou proparacaïne , connue sous les noms commerciaux Alcaine, Ak-Taine et autres, est un anesthésique topique du groupe des esters aminés. Il est indiqué pour une utilisation comme anesthésique ophtalmique pour réduire la douleur et l'inconfort dans les yeux. Proposer un design de synthèse pour cet anesthésique, à partir de matériaux simples et abordables. |
|
Analyse rétrosynthétique : La déconnexion initiale acyl-oxygène de la proxyméthacaïne conduit à nouveau à un acide m-aminobenzoïque, avec un substituant alcoxyde en position para et un aminoalcool formé à partir de l'amine et de l'époxyde correspondants.
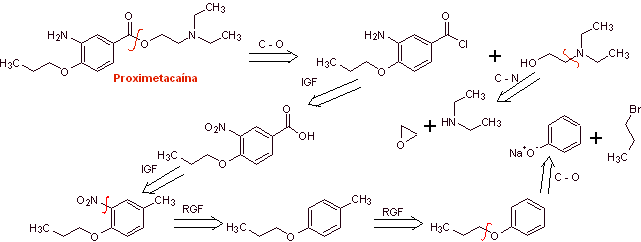
Synthèse de la proximéthacaïne :
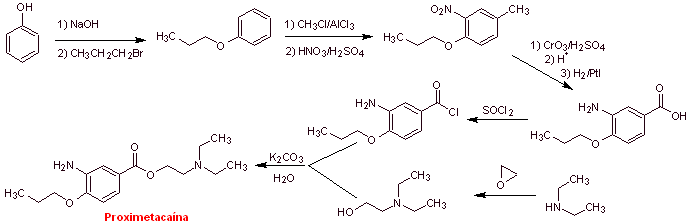
Lire la suite : Synthèse d'anesthésiques locaux dérivés de l'acide aminobenzoïque
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 30308
Synthèse d'anesthésiques locaux dérivés des phénylacétamides
Une liste des principaux composants de ce groupe d'anesthésiques est présentée ensuite:
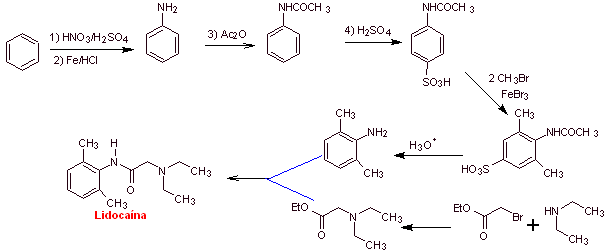
Lidocaïne (lignocaïne, xylocaïne), mépivacaïne, étidocaïne, articaïne (carticaïne), bupivacaïne, prilocaïne, dibucaïne (cincocaïne), ropivacaïne, trimécaïne, butanylicaïne, clibucaïne, tolicaïne, trimécaïne, vadocaïne ou xitazaïne, anidicaïne, diméthisoquine, oxétazine, pyrrocaïne, paramoxine, properacaïne, oxétacaïne.
|
Mob 19 ; |
|
Analyse rétrosynthétique :
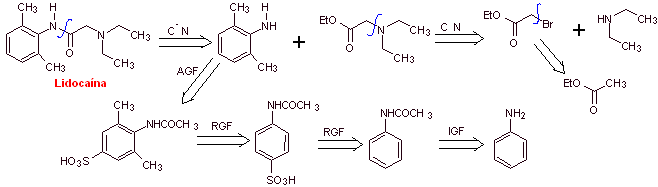
Synthèse de
|
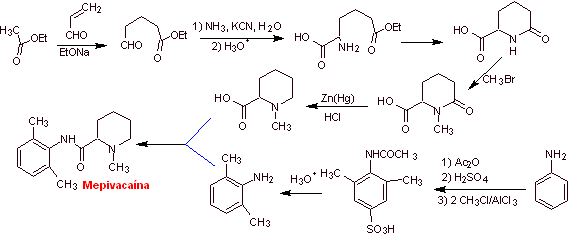
MOb 20 : La mépivacaïne est un anesthésique local de type amide, elle agit plus rapidement que la procaïne, mais son effet anesthésique est plus court que celui de la procaïne. Comme la plupart des anesthésiques, il est fourni sous forme de sel de chlorhydrate de racémate. |
|
Analyse rétrosynthétique : La déconnexion initiale par la liaison amide génère deux molécules précurseurs dont l'une, la 2,6-diméthylaniline, a déjà été synthétisée en
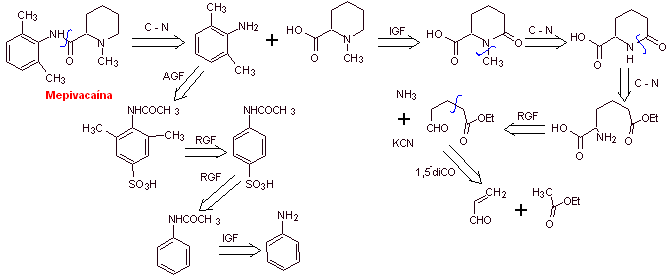
Synthèse de la mépivacaïne :
Lire la suite : Synthèse d'anesthésiques locaux dérivés des phénylacétamides
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 18641
Synthèse d'anesthésiques locaux dérivés de divers groupes fonctionnels
Il existe des analgésiques qui, étant dérivés de groupes fonctionnels autres que l'acide benzoïque, l'acide aminobenzoïque ou le phénylacétamide, ont également des propriétés analgésiques similaires aux médicaments précédemment synthétisés. Les plus représentatifs de ce groupe sont les suivants :
Phénacaïne, promocaïne (pramoxine), bucricaïne, chlorure d'éthyle, diméthisoquine, diperodon , kétocaïne, myrtécaïne, octacaïne, dyclonine (diclocaïne)
|
MOb 29 : La dyclonine est un anesthésique oral à Sucrets, une autre pastille pour la gorge. On le trouve également dans certaines variétés de spray Cepacol contre les maux de gorge. Proposer la synthèse du médicament. |
 |
Analyse rétrosynthétique : La structure de la cétoamine permet de proposer une déconnexion liée à la réaction de Mannich (méthylcétone + formaldéhyde + amine secondaire). Les déconnexions ultérieures des molécules précurseurs sont liées à des réactions chimiques relativement simples et à haut rendement.
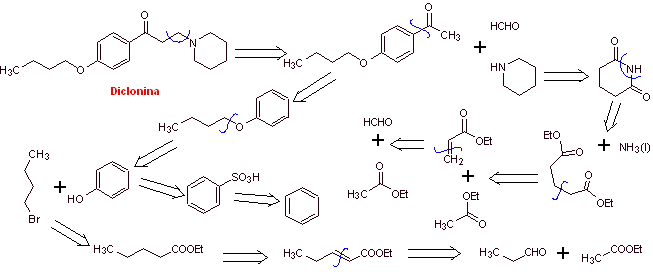
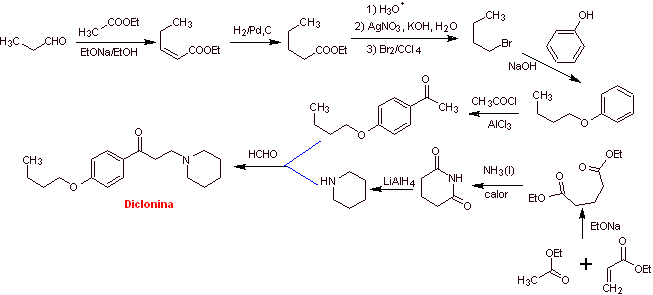
Synthèse de la dyclonine :
|
MOb 30 : La pramocaïne ( également connue sous le nom de pramoxine), est un anesthésique topique utilisé comme antiprurigineux. Son chlorhydrate est soluble dans l'eau et donc plus facilement absorbé par la peau. Proposer un design de synthèse de cette molécule à partir de matériaux simples et abordables. |
|
Analyse rétrosynthétique :
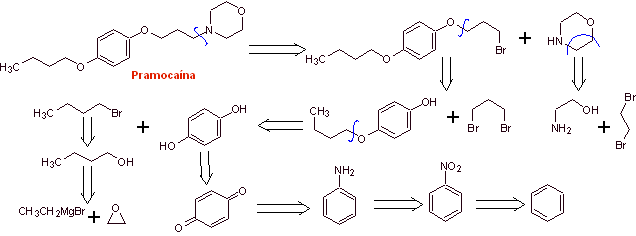
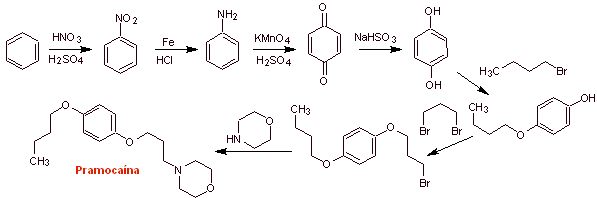
Synthèse de pramocaïne :
Lire la suite : Synthèse d'anesthésiques locaux dérivés de divers groupes fonctionnels
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 13747
Synthèse de polyaspartate (rootGrow)
1. Synthèse de polyaspartate (rootGrow)
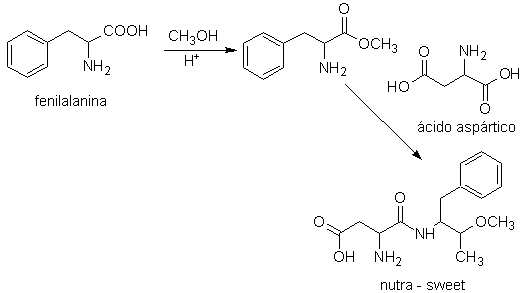
On prétend que la formule de rootGROW est apparentée à celle du nutra-sweet (aspartame), un édulcorant puissant, qui est en train d'être retiré ou a déjà été retiré du marché, en raison de ses effets nocifs sur la santé des personnes.
Nutra-sweet peut être synthétisé à partir de la phénylalanine, selon le schéma suivant :
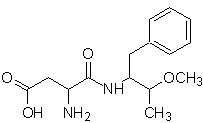
nutra doux
A son tour, l'acide aspartique, base fondamentale, pour obtenir le rootGrow, qui peut être dextrogyre (D) ou lévogyre (L), est préparé selon les schémas de synthèse suivants :
Schéma A : (processus de transamination)
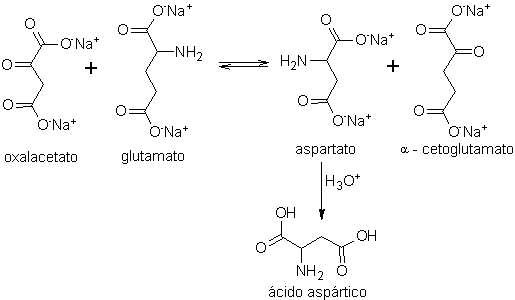
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 26150
Synthèse de composés 1,3 et 1,5-dicarbonyle
Proposer un design de synthèse par la méthode de déconnexion (méthode synthon) à partir de matériaux simples et abordables, pour les molécules suivantes :
(Rappelons que s'il n'est pas possible de proposer une déconnexion directe, il faudra recourir à la stratégie de fonctionnalisation préalable du MOb, jusqu'à aboutir à un modèle de déconnexion applicable)
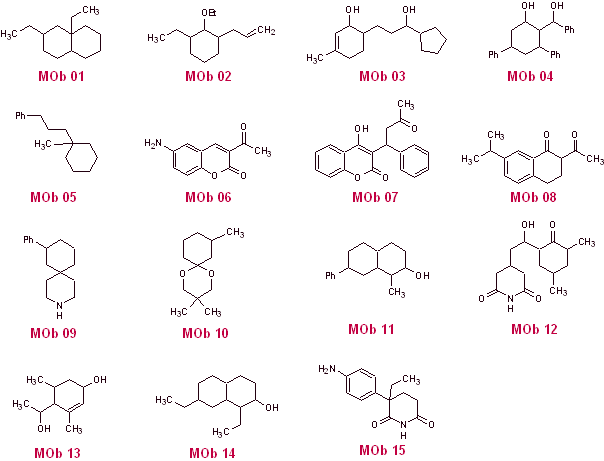
SOLUTIONS AUX PROBLÈMES PROPOSÉS
MOb 01 n'a pas de rapport dioxygène, un aspect qui, dans un certain sens, est un avantage pour le chimiste. C'est-à-dire que la stratégie à utiliser permettra la recherche de relations dioxygénées dans la molécule précurseur (équivalent synthétique) avec un certain degré de liberté, c'est-à-dire qu'on pourra postuler, en fonction de la structure du MOb, une gamme de dicarbonyl et/ou les relations hydroxycarbonyle, en positions relatives 1.2, 1.3 , 1.4, 1.5 et/ou 1.6 ou leurs variants, tels que les composés carbonylés α, β-insaturés.
A cette occasion, la synthèse s'exercera en recourant aux rapports dioxygénés 1,3 et/ou 1,5. De cette manière, la molécule cible et les précurseurs seront convertis en structures déconnectables selon un schéma connu et préétabli.
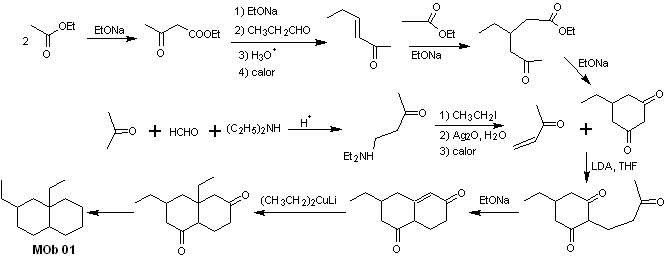
Solution MOb 01
Analyse rétrosynthétique : Dans la molécule en question, on peut commencer par effectuer un AGF, en plaçant un groupe C=O dans la structure de la molécule précurseur, dans une telle position, qui permet plus tard de faire un autre AGF, avec une double liaison située sur le carbone alpha et bêta par rapport au carbonyle, pour procéder pour le déconnecter.
L'insaturation α, β, par rapport à C=O, doit être recherchée comme l'alcène le plus substitué des alternatives qui pourraient exister. La présence d'un substituant en position bêta en C=O laisse penser qu'il aurait pu s'ajouter comme nucléophile à un composé carbonylé α,β insaturé, selon la réaction d'addition conjuguée de Michael. Sur la base de ces considérations, l'analyse rétrosynthétique suivante peut être postulée pour MOb 01 :
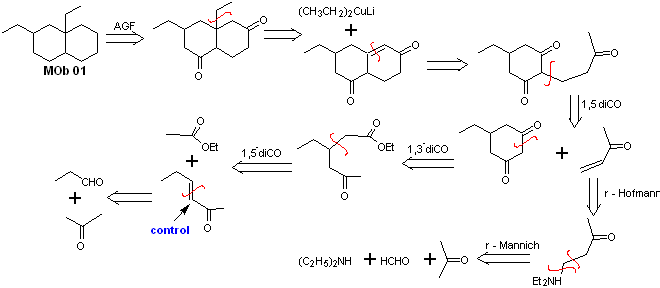
Synthèse de MOb 01 : La condensation entre un aldéhyde énolisable et une cétone produit normalement des produits d'autocondensation ou de condensation croisée. Cela peut être évité, en recourant à la stratégie du contrôle, chez le nucléophile du cétone, comme on peut le voir dans le schéma ci-joint.
D'autre part, lorsqu'il est nécessaire d'utiliser des cétones vinyliques comme substrat dans la réaction de Michael, cela signifierait l'utilisation de formaldéhyde. Malheureusement, cet aldéhyde, étant très réactif en milieu basique, a tendance à provoquer des réactions de polymérisation, qui abaissent drastiquement le rendement de la synthèse.Pour cette raison, la réaction de Mannich et l'élimination d'Hofmann sont adéquatement combinées pour les vinylcétones à hauts rendements.
L'élimination d'Hofmann pourrait être réalisée dans le même milieu basique que celui utilisé pour la réaction de Michael, il n'est donc pas nécessaire d'isoler la vinylcétone.
Cependant, du fait de l'expérience encore limitée en synthèse, l'utilisation d'oxyde d'argent en milieu aqueux sera postulée pour réaliser l'élimination de l'amine et la formation de la vinylcétone.
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 43122
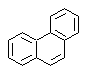
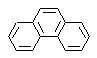
Synthèse de phénanthrène
(Méthode de l'arbre de synthèse)
Le phénanthrène est un hydrocarbure aromatique polycyclique, qui contient trois cycles benzéniques condensés, c'est pourquoi il est un isomère de l'anthracène.
|
|
soit |
|
Les méthodes de synthèse traditionnelles du phénanthrène, celles qui impliquent la formation de cycles et leur "aromatisation" ultérieure, sont liées à celles proposées par Haworth et Bardhan - Sengupta (1932), comme on le verra ci-dessous.
Il est également possible de proposer d'autres méthodes nouvelles, pour le Phénanthrène et en général pour les composés aromatiques polycycliques, sur la base de l'utilisation appropriée des réactions de couplage d'Ullman, de la réaction de Heck, de la réaction de Suzuki et de la réaction de MacMurry, ainsi que de la variantes et extensions qui présentent ces réactions.
pour) La synthèse de Haworth :
Cette méthode est basée sur la réaction d'acylation de Friedel-Crafts et présente l'inconvénient que la cyclisation finale pour former le troisième cycle fusionné au naphtalène n'est pas sélective, car il est également possible que la fermeture se produise dans l'autre carbone adjacent au groupe qui contient la fonction carboxylique et forme ainsi un isomère, qui du fait des conditions réactionnelles s'avère minoritaire.
Méthode A :
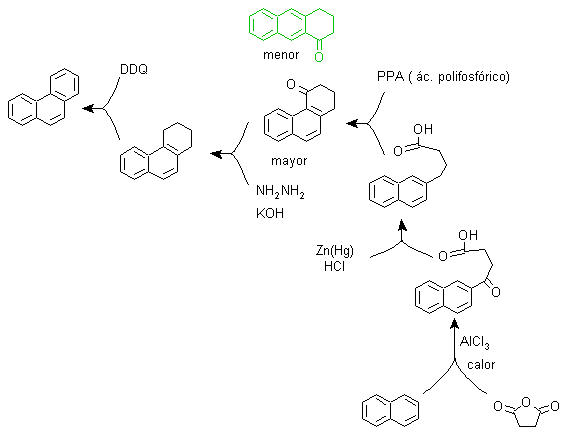
Les matières premières sont généralement le naphtalène et l'anhydride succinique. Pour s'assurer que la réaction d'acylation avec l'anhydride se produit au niveau du carbone 2 (bêta) du naphtalène, il est nécessaire d'effectuer la réaction à une température supérieure à 60 ºC.
A température ambiante, la position d'acylation sera le carbone 1 (alpha), ce qui donne lieu à une variante de la méthode, qui, cependant, sont essentiellement les mêmes réactions qui se produisent et il y a aussi la formation d'un autre isomère qui est beaucoup moins important que dans le premier cas. Par conséquent, il est de préférence utilisé comme réaction officielle pour la préparation du phénanthrène par la méthode Howorth.
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 31761
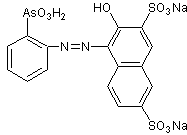
SYNTHÈSE DE THORINE
Les applications analytiques de la thorine, les paramètres de travail, ses limites et ses perspectives, sont abordés et expliqués de manière suffisamment détaillée dans des publications spécialisées en analyse chimique telles que Analytical Chemistry . Un bref résumé de ceux-ci montre les applications suivantes:
En milieu acide : il est utilisé pour le dosage quantitatif des éléments thorium (Th), zirconium (Zr), fluor (F), hafnium (Hf) et uranium (U).
En milieu basique : La forme acide disulfonique de la thorine, plus connue sous le nom de Thoron, est utilisée dans le dosage quantitatif du lithium (Li).
En milieu neutre : la thorine est utilisée comme indicateur pour le dosage des ions sulfate (SO 4 2- ) dans les solutions aqueuses.
Thorin est également utilisé pour déterminer le SO 2 dans l'air.
Problème de recherche.
Compte tenu de la demande de ce réactif pour différentes déterminations analytiques et notamment pour l'analyse colorimétrique du lithium dans les saumures du Gran Salar de Uyuni et de la faible offre de celui-ci sur le marché national, le besoin se fait sentir de synthétiser la thorine, à partir de matériaux simples et abordables . dans notre environnement.
Dans ce but, les voies de synthèse conçues sont abordées à partir du paradigme RÉTROSYNTHÈSE , en appliquant les méthodes des Feuilles de Synthèse, la Méthode de Déconnexion ou Synthon et la Méthode de l'Arbre. de Synthèse.
En ce qui concerne la synthèse du thorin , il existe une description brève et résumée de la synthèse du thoron dans la littérature , selon la direction proposée par Kuznetsov , c'est-à-dire qu'il est indiqué que pour la préparation du thoron, il faut que l'acide o-aminophénylarsonique soit diazocopulé avec le sel disodique de l'acide 2-naptol-3,6-disulfonique (sel R) dans un milieu acide.
Conception de synthèse pour le Thorina .
La création est abordée par la méthode des déconnexions ou Sintón, qui envisage deux étapes. Le premier est lié à l'analyse rétrosynthétique et le second à la synthèse dans le sens de ce qui se passe en laboratoire, c'est-à-dire depuis les matières premières jusqu'à arriver à la Molécule Cible (MOb).
pour) Articles structure et réactivité à prendre en compte, pour l'analyse rétrosynthétique
La thorine est typiquement un composé azoïque, donc un colorant. La préparation de ces composés comprend généralement deux réactions fondamentales qui sont : la diazoation et le diazocouplage (ou simplement couplage).
En revanche, toutes les molécules précurseurs de couplage utilisées pour la formation des colorants azoïques ont un caractère commun, à savoir : un atome d'hydrogène actif lié à un atome de carbone.
Les composés suivants sont largement utilisés comme molécules précurseurs (substrats) pour le couplage : les composés qui ont des hydroxyles phénoliques, tels que les phénols et les naphtols, les amines aromatiques, les molécules avec des groupes cétones aliphatiques énolisables, et les molécules hétérocycliques telles que le pyrrole, l'indole, etc. .
Par rapport à la réaction de copulation, certains principes heuristiques doivent être pris en compte, à savoir :
· Les phénols se couplent plus facilement que les amines et les membres de la série des naphtalènes plus facilement que le benzène.
· Les substituants à effet inductif négatif (-I), tels que les halogènes, les groupes nitro, sulfa, carboxyle et carbonyle retardent le couplage.
· Un groupe alkyle ou alcoxy en position ortho ou méta par rapport à un groupe amino favorise le couplage. Et s'ils sont en positions 2 et 5 par rapport au groupe amino, ce sont surtout de bons coupleurs.
· Dans la série benzénique, le couplage se produit habituellement en position para par rapport au groupe hydroxyle (-OH) ou amino (-NH 2 ). Si la position pour est occupée, le lien se produit à la position ortho.
· Dans la série naphtalène, lorsque le groupe amino hydroxyle est en position 2 ( b ), le réactif est couplé en position 1 ( a ). Si le groupe hydroxyle ou amino est en position alpha, la liaison se produit généralement en position 4 ; mais si la position 3 ou 6 est occupée par un groupement sulfonique, l'union a lieu en position bêta.
· Lorsqu'il y a deux positions possibles de couplage, la position de la liaison est fréquemment déterminée par le pH du milieu : Le couplage se fait en ortho avec le groupement amino lorsqu'il est réalisé en milieu acide et en ortho avec le groupement hydroxyle lorsqu'il elle est réalisée en milieu basique. .
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 59192
SYNTHÈSE DES BENZODIAZÉPINES (BDZ)
Pour. Wilbert Rivera Munoz
Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser.
Ces
substances produisent une grande variété