Synthèse d'anesthésiques locaux dérivés de l'acide benzoïque
|
Les propriétés des alcaloïdes isolés des feuilles de la plante de coca ont été découvertes pour la première fois par Gaediche en 1855, la purification et l'isolement du principe actif appelé cocaïne par Albert Nieman en 1860, ont pratiquement commencé l'histoire des anesthésiques locaux. . Par la suite, Einhorn a introduit la procaïne (novocaïne) comme anesthésique local en médecine en 1904. |
|
Depuis, l'humanité a assisté à un développement continu et soutenu de la synthèse de nouvelles molécules aux principes actifs anesthésiques :
![]() En 1925, Niescher a synthétisé la nupercaïne.
En 1925, Niescher a synthétisé la nupercaïne.
![]() En 1928 Von Eisleb tétracaïne (pantocaïne) et
En 1928 Von Eisleb tétracaïne (pantocaïne) et
![]() En 1946, Lofgren et Lundquist ont synthétisé la lognicaïne (xylocaïne ou lidocaïne).
En 1946, Lofgren et Lundquist ont synthétisé la lognicaïne (xylocaïne ou lidocaïne).
![]() Puis en 1954 Af Ekenstam et Egner obtiennent la synthèse de la mépivacaïne (scandicaine).
Puis en 1954 Af Ekenstam et Egner obtiennent la synthèse de la mépivacaïne (scandicaine).
![]() Plus tard en 1960 et 1964, ils ont été introduits dans
Plus tard en 1960 et 1964, ils ont été introduits dans
![]() Enfin, dans les années suivantes, de nouveaux anesthésiques ont été intégrés à la médecine.
Enfin, dans les années suivantes, de nouveaux anesthésiques ont été intégrés à la médecine.
Les anesthésiques locaux sont des médicaments qui, lorsqu'ils sont appliqués sur une zone spécifique du corps, produisent une perte de sensibilité temporaire et réversible (thermique, douloureuse et tactile), sans inhibition de la conscience du patient. La durée de l'effet du médicament dépend de la dose utilisée, de sa structure chimique, de la formulation et de la forme pharmaceutique du médicament.
En général, les médicaments anesthésiques locaux répondent à différentes structures chimiques, mais tous ont des effets similaires ou des intensités différentes de l'effet anesthésique. Cependant, on peut tenter de les regrouper en esters d'acide benzoïque, esters d'acide aminobenzoïque, amides, etc.
1 . Structure chimique des anesthésiques locaux
Les anesthésiques locaux sont principalement des bases faibles et sont formés par un groupe arène, ester ou amide, qui confère à la molécule des propriétés lipophiles (qui déterminent principalement la puissance du médicament), un groupe amino tertiaire aliphatique (alkyle ou alicyclique), qui confère à la molécule son caractère hydrophile, et une chaîne intermédiaire alkyle qui relie les parties de l'arène avec l'amine et est responsable du niveau de toxicité de la drogue.
Ainsi, les principaux anesthésiques locaux utilisés dans les différentes disciplines médicales se retrouvent dans les groupes suivants :
pour) Esters aminés de l'acide benzoïque :
b) Esters d'acide m-aminobenzoïque :
c) Esters d'acide p-aminobenzoïque :
d) Amides :
et) Cétones :
F) autres groupes
2 . Synthèse d'anesthésiques locaux dérivés d'esters aminés de l'acide benzoïque
Les drogues les plus représentatives de ce groupe sont la cocaïne, l'hexylcaïne, la pipérocaïne, l'aminobenzoate d'éthyle, la méprilcaïne, l'amylocaïne, la cyclométhicaïne et la propanocaïne. Ces noms répondent
Ensuite, la synthèse de plusieurs d'entre eux sera présentée en détail, à titre d'exemple d'application de la méthodologie de synthèse, dite méthode de déconnexion ou synthon.L'ordre d'exposition n'a aucun rapport avec la plus ou moins grande importance de ces L'objectif recherché est de se plonger dans l'étude de la synthèse chimique de ces médicaments. exister traités spécialisés sur la pharmacocinétique et la pharmacodynamique de ces molécules.
|
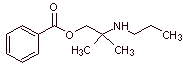
MOb 01 : Le chlorhydrate d'hexylcaïne , également appelé cyclaïne (Merck) ou osmocaïne, est un anesthésique local à courte durée d'action. Proposer un design de synthèse, à partir de matériaux simples et abordables, pour ce médicament. |
|
Analyse rétrosynthétique : La présence de l'amine secondaire dans la structure de
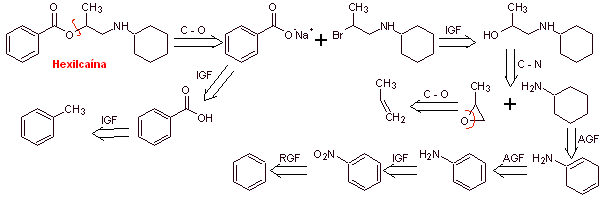
Synthèse de l'hexylcaïne : L'aminoalcool requis comme intermédiaire est préparé par le ouverture de l'époxyde approprié avec l'amine primaire (nucléophile) correspondante.
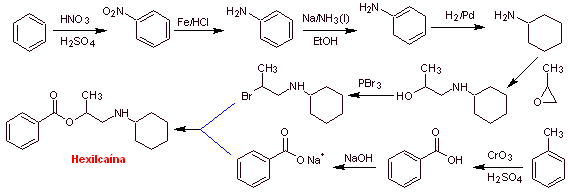
|
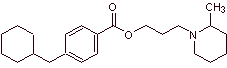
MOb 02. La pipérocaïne est un anesthésique local utilisé sous forme de chlorhydrate. Proposer un plan de synthèse pour ce médicament. |
|
Analyse rétrosynthétique : La structure de
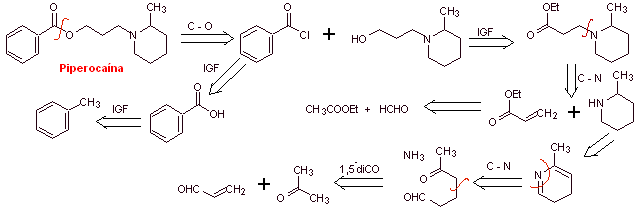
Synthèse de
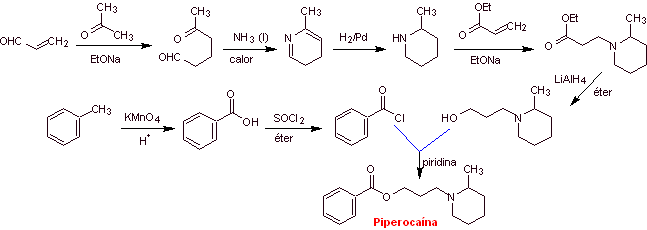
|
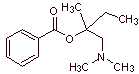
MOb 03 : La méprilcaïne, également appelée épirocaïne , est un anesthésique local de durée modérée. Proposer un design de synthèse de cette molécule à partir de matériaux simples et abordables. |
|
Analyse rétrosynthétique : La structure de
La déconnexion des deux molécules précurseurs est ensuite poursuivie, la liaison CN de l'amide est déconnectée et cette opération est poursuivie jusqu'à atteindre l'acétate d'éthyle et le toluène comme matières premières.
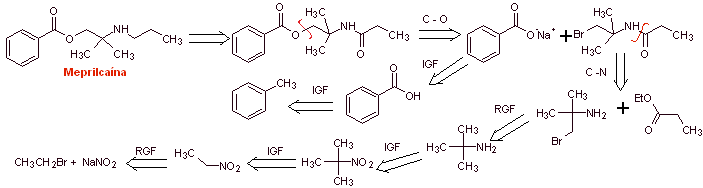
Synthèse de
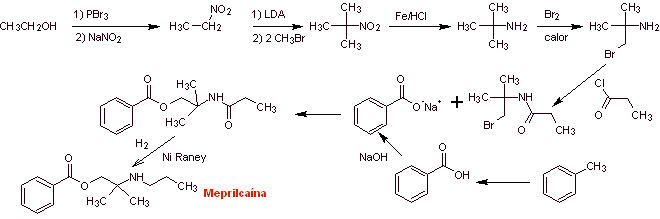
|
MOb 04 : L'Amylocaïne a été le premier anesthésique local synthétique breveté par Ernest Fourneau Stovaine (Français) à l'Institut Pasteur en 1903. Proposer un design de synthèse pour cette molécule, à partir de matériaux simples et abordables |
|
Analyse rétrosynthétique : Le processus de déconnexion commence par la liaison acyl-oxygène, la déconnexion ultérieure de la liaison NC de l'amino-alcool, découvre la structure d'un époxyde substitué et de la diméthylamine comme molécules précurseurs. L'époxyde peut être formé à partir d'une cétone avec de l'ylure de soufre.
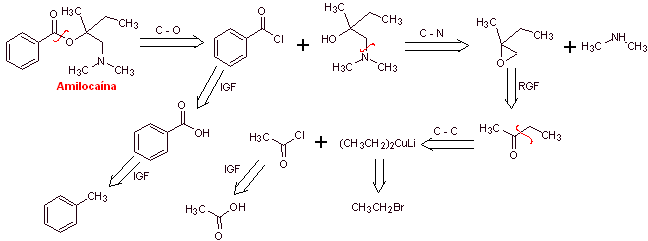
Synthèse d'amylocaïne : La molécule précurseur de 2-butanone requise peut être préparée à partir d'acide acétique et du réactif de Gillman correspondant. Ce qui conduit à préparer l'époxyde à partir de la même cétone, en utilisant l'ylure de soufre respectif, pour introduire le groupe méthylène (–CH 2 -).
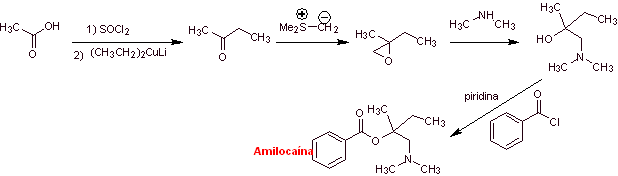
|
MOb 05 : La cyclométhicaïne est un autre anesthésique local important. Proposer un plan de synthèse de ce médicament, à partir de matériaux simples et abordables. |
|
Analyse rétrosynthétique : La déconnexion commence par la liaison acyl-oxygène du groupe ester puis se poursuit avec les déconnexions des deux molécules précurseurs générées, jusqu'à arriver au benzène, toluène, cétone et acide acétique comme matières premières.
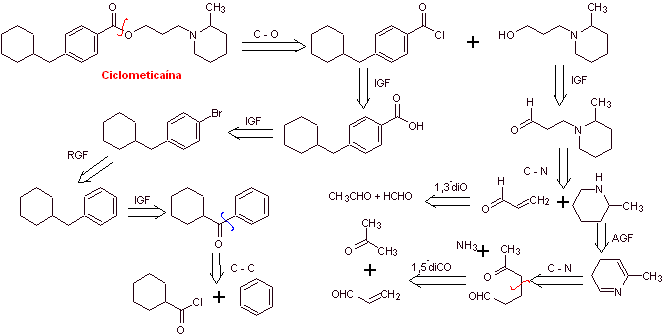
Synthèse de la cyclométhicaïne :
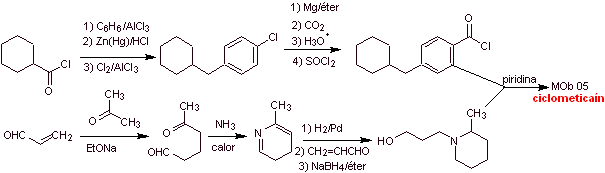
|
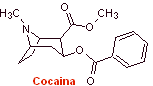
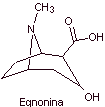
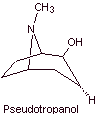
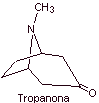
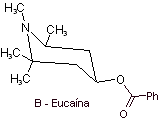
MOb 06 : La cocaïne est le premier anesthésique local d'origine naturelle, obtenu à partir de feuilles de coca, et malheureusement elle a été utilisée le plus souvent sans scrupule en raison de ses effets hallucinogènes. Malgré cela, plusieurs dérivés de la cocaïne ont été obtenus, tous utilisés comme anesthésiques locaux, comme l'ecgonine, |
|
|
|
… |
|
|
|
|
|
|
|
|
|
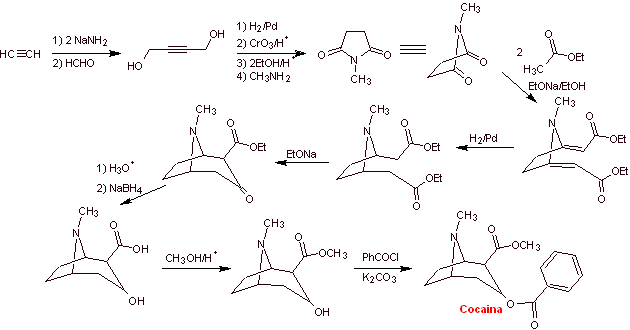
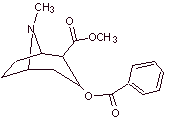
A des fins essentiellement médicales et thérapeutiques, la cocaïne a été synthétisée dans des laboratoires de chimie. Décrire une voie possible de synthèse chimique de la cocaïne à partir de matériaux simples.
Analyse rétrosynthétique : La déconnexion est initiée par la liaison acyl oxygène de l'ester directement attaché au composé bicyclique, un aspect qui simplifie grandement la structure et forme des molécules précurseurs, beaucoup plus faciles à traiter dans leurs déconnexions. Puis l'egnonine se forme, la même qui est déconnectée par une rétro-condensation de Claisen, pour continuer avec une rétro Knoevenagel. Les déconnexions ultérieures génèrent des molécules précurseurs qui vont jusqu'à l'acétylène et le formaldéhyde comme matières premières.
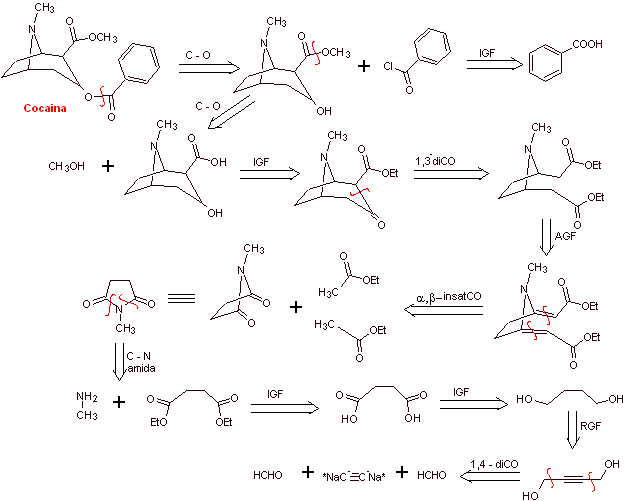
Synthèse de