Synthèse d'isoquinoline
(Par la méthode des déconnexions)
|
|
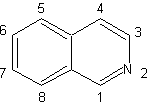
Les isoquinoléines diffèrent structurellement des quinoléines dans la position l'azote, puisque ce dernier n'est pas fusionné, il présente donc une "réactivité aliphatique". On ne le trouve pas libre dans la nature, mais le cycle de l'isoquinoléine se retrouve dans certains alcaloïdes, sous forme aromatique ou réduite, par exemple la papavérine. |
Les méthodes de synthèse les plus connues pour la préparation des isoquinoléines partent des 2-phényléthylamines et impliquent une cyclisation par un carbone supplémentaire fourni par le groupe carbonyle d'un autre composé.
Les principales méthodes de synthèse sont : la synthèse Pomeranz-Fritsch, la synthèse Bischler-Napieralski, la synthèse Pictet-Gams et la synthèse Pictet-Spengler.
1. Synthèse de POMERANZ-FRITSCH.
Cette méthode de synthèse de l'isoquinoline se déroule en deux étapes :
pour. Tout d'abord, le benzaldéhyde (1,3-électrophile-nucléophile) est condensé avec le diéthylacétal d'aminoacétaldéhyde (1,3-nucléophile-électrophile) pour former une aldimine stable.
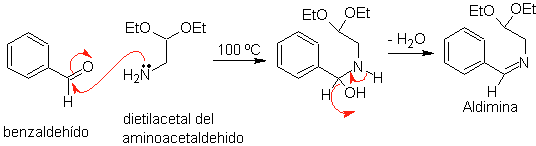
b. Par la suite, l'aldimine se cyclise en milieu acide fort, en imine, avec élimination simultanée d'éthanol, pour donner une isoquinoline.
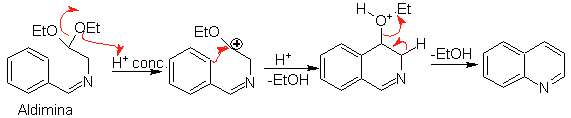
Cette deuxième étape, étant une substitution électrophile, est soumise à l'effet que les substituants donneurs ou accepteurs d'électrons ont sur le cycle benzénique dans ladite réaction. Cependant, du fait de l'hydrolyse de l'imine formée, dans le milieu acide fort utilisé dans la réaction, le rendement du procédé est réduit.
Cette méthode permet d'accéder aux isoquinoléines substituées en C-1, pour lesquelles des cétones aromatiques ont été testées, avec des rendements très faibles. Cependant, il y a eu un plus grand succès en utilisant la variante des benzylamines substituées de manière appropriée comme 1,4-dinucléophiles et du diéthylacétal de glyoxal comme 1,2-diélectrophiles.
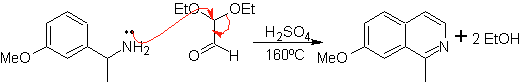
Ce qu'il faut préciser, c'est que la méthode Pomeranz-Fritsch et sa variante, précédemment analysée, ne permettent pas la préparation d'isoquinoléines substituées en C-3 et C-4 de l'hétéroatome. L'analyse rétrosynthétique de cette méthode montre les éventuels intermédiaires impliqués dans la réaction et les matières premières probables.
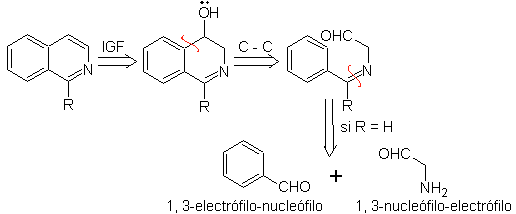
|
Proposer un design de synthèse pour chacune des isoquinoléines suivantes :
|
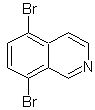
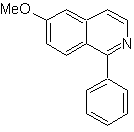
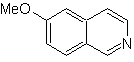
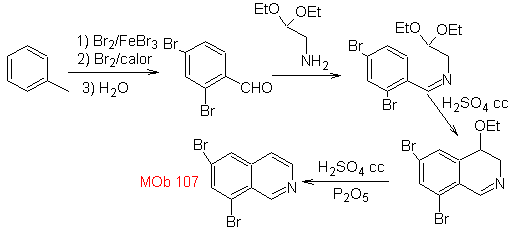
Mob 107
|
|
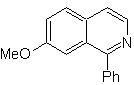
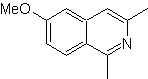
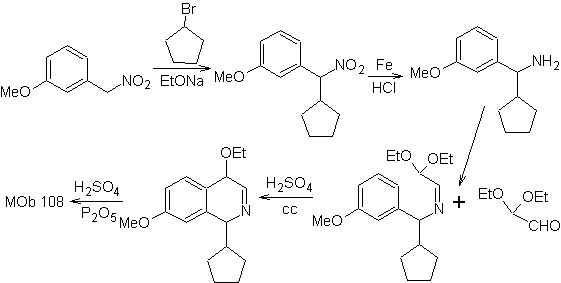
Mob 108
|
MOb 107 . Analyse rétrosynthétique . La déconnexion de
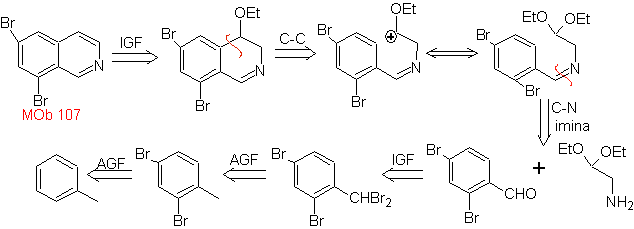
MOb 108. Analyse rétrosynthétique . La présence d'un substituant sur C1 de l'isoquinoline, conduit à déconnecter
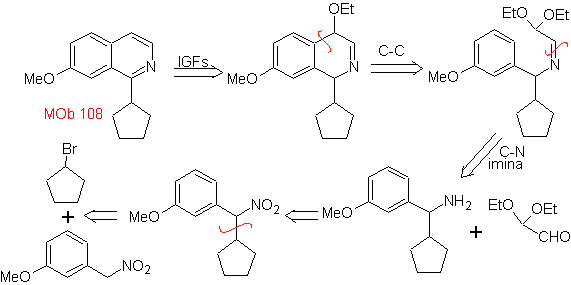
Synthèse Le dérivé de benzyalmine est préparé pour réagir avec le diacétal d'aminoaldéhyde, selon la synthèse de Pomeranz-Fritsch, pour former
2. Synthèse de BISCHLER-NAPIERALSKI .
Cette méthode de synthèse des isoquinoléines implique la réaction d'une phénéthylamine (1,5-dinucléophile) avec un chlorure ou un anhydride d'acide (électrophile) pour former un amide, dont la cyclisation avec perte d'eau conduit à une 2,4-dihydroisoquinoléine avec un substituant à C-1, qui est oxydé en isoquinoléine avec du Pd-C ou du disulfure de phényle.
L'étape de cyclisation est une substitution aromatique électrophile et sera donc favorisée par des substituants donneurs d'électrons sur le cycle aromatique de la phénéthylamine. Les phénéthylamines m-substituées conduisent exclusivement à des isoquinoléines substituées en C-6, du fait de la cyclisation en position para par rapport au groupement activateur.
L'analyse rétrosynthétique des isoquinoléines préparées par cette méthode est la suivante :
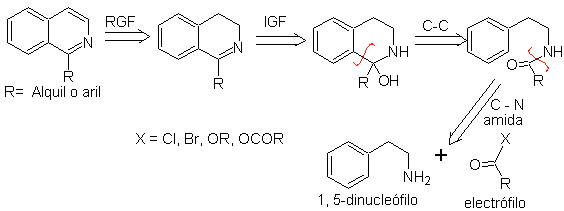
Les agents de cyclisation les plus fréquemment utilisés dans cette synthèse sont :
pour. P 2 O 5 (pentoxyde de phosphore)
b. POCl 3 (oxychlorure de phosphore) et
c. SOCl 2 (chlorure de thionyle)
|
Proposer un plan de synthèse pour les isoquinoléines suivantes :
|
Mob 109
|
|
Mob 110
|
MOb 109 . Analyse rétrosynthétique .
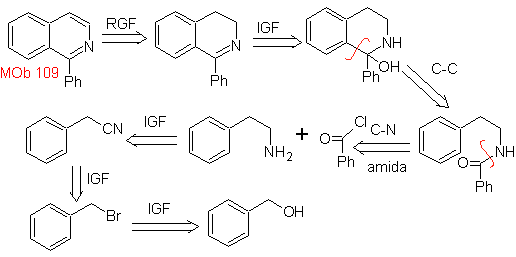
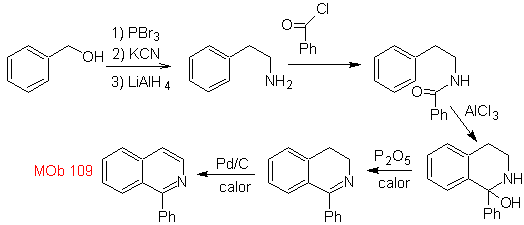
La synthèse. L'alcool benzylique est un bon matériau de départ pour former la phénéthylamine, qui est combinée avec le chlorure de benzoyle. Le produit est cyclisé et aromatisé avec du Pd/C et chauffé pour former
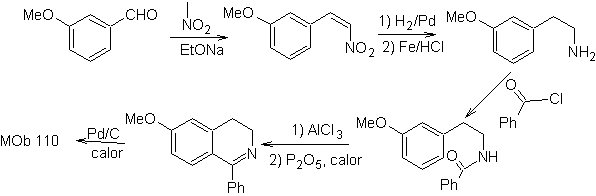
MOb 110. Analyse rétrosynthétique.
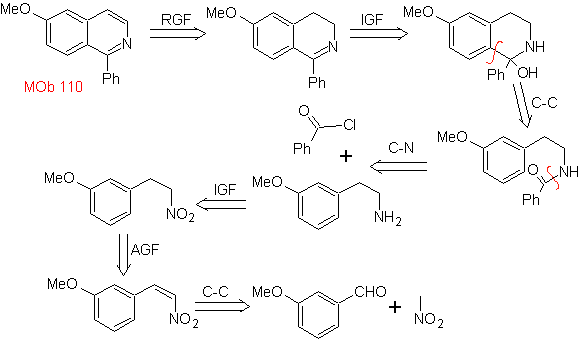
La synthèse. La synthèse de
3. Synthèse PICTET-GAMS.
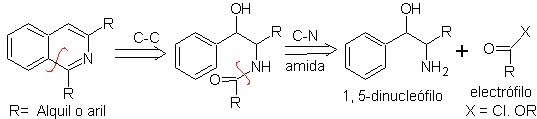
C'est une variante de la synthèse de Bischler-Napieralski, dans cette méthode on utilise des phénéthylamines potentiellement insaturées, obtenant un hétérocycle totalement aromatique, donc l'application d'oxydants n'est pas nécessaire.
L'analyse rétrosynthétique de cette méthode montre les reconnexions potentielles et les matériaux de départ suivants.
|
Proposer un design de synthèse pour l'isoquinoline suivante :
|
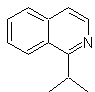
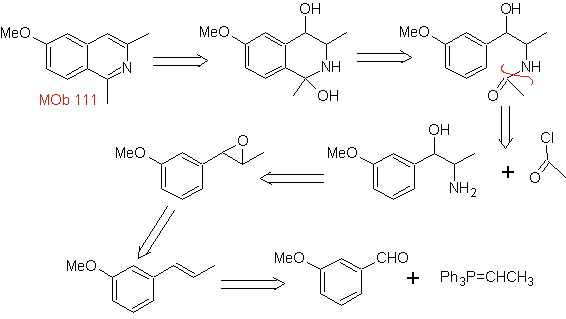
Mob 111.
|
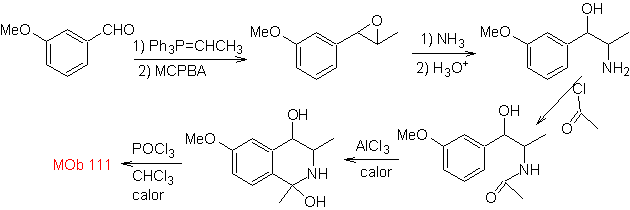
MOb 111 . Analyse rétrosynthétique . Pour initier la déconnexion
synthèse . La synthèse Pictet-Gams est appliquée, il n'est donc pas nécessaire d'utiliser un oxydant à la fin, pour parvenir à la formation de
Les phénéthylamines peuvent également réagir avec des aldéhydes avec de bons rendements, donnant des aldimines qui peuvent se cycliser en milieu acide en 1,2,3,4-tétrahydroisoquinoléines, qui doivent être oxydées pour produire des isoquinoléines.
Cette cyclisation nécessite des substituants activateurs convenablement placés pour activer les positions ortho par rapport au groupe aminoéthyle, c'est pourquoi la fermeture du cycle se produit toujours en position para par rapport à l'activateur.
Lorsque le cycle aromatique est activé avec des substituants hydroxyle, la fermeture du cycle se produit dans des conditions très douces, en raison de l'effet fortement activateur de OH-
Analyse rétrosynthétique d'une isoquinoline formée par la méthode Pictet-Spengler , montre les déconnexions et matériaux de départ suivants :
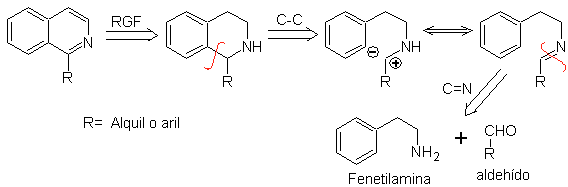
|
Proposer un plan de synthèse pour les Isoquinoléines suivantes :
|
Mob 112
|
….. |
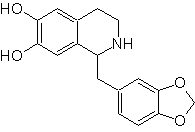
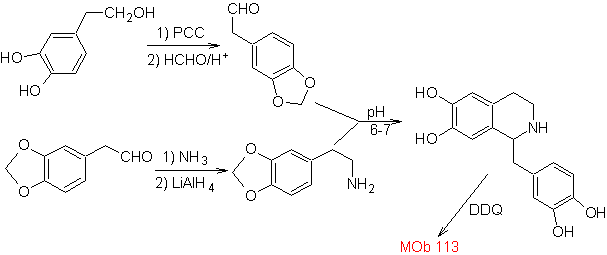
Ob 113
|
MOb 112. Analyse rétrosynthétique .
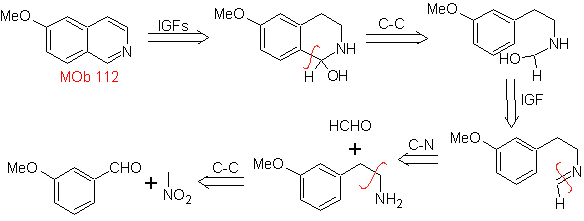
synthèse . La cyclisation se produit en milieu acide et le DDG sert à aromatiser l'hydroisoquinoléine formée pour préparer
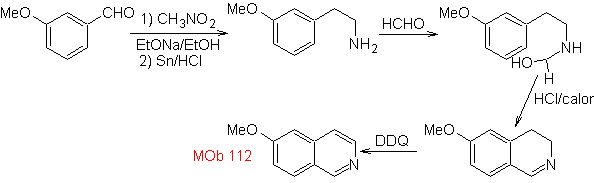
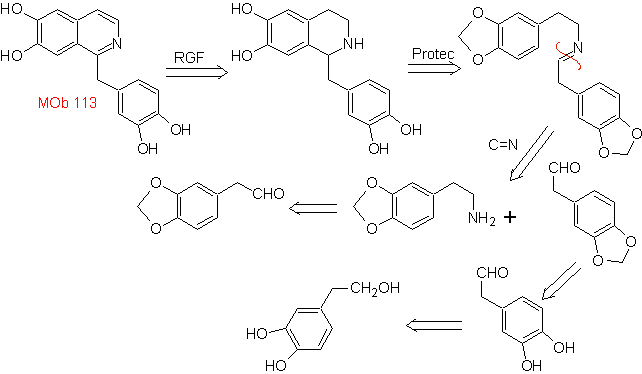
La synthèse La synthèse Pictet-Spengler est appliquée pour former
Amé Pictet (1857-1937) était l'un des six membres de la représentation suisse et a été secrétaire du Congrès chimique de Genève . En tant que représentant de