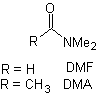Réactions des énols et des énolates
Réactions d'aldol et réactions dites de condensation de composés carbonylés et autres de ce type, qui peuvent former des structures énols et énolates, participent à un grand nombre de réactions importantes qui nous permettent de comprendre l'existence d'un nombre immense de molécules résultant de l'interaction d'énols ou d'énolates avec une série de groupes électrophiles.
L'étude de ce type de réaction a permis de vérifier et d'établir l'existence de deux mécanismes réactionnels par lesquels elles se produisent, comme expliqué ci-dessous :
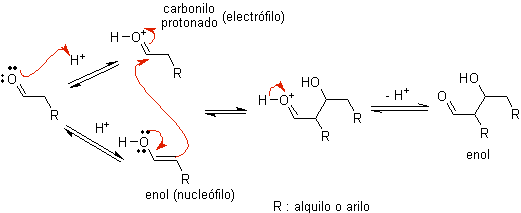
POUR) Lorsqu'un acide est utilisé comme catalyseur, le composé carbonyle est initialement protoné puis tautomérisé en sa forme énol , qui est un nucléophile sur le carbone alpha du groupe carbonyle. Le même milieu acide suffit à activer le groupe carbonyle d'une autre molécule, la rendant hautement électrophile, ce qui génère des conditions optimales pour produire un composé carbonyle insaturé.
La réaction se déroule normalement jusqu'à la déshydratation de l'énol formé, catalysée par le même acide de la réaction.
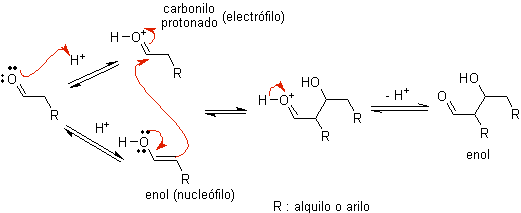
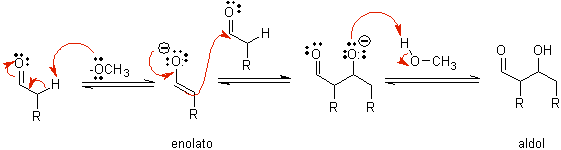
B) Lorsque le catalyseur est une base, telle qu'un alcoxyde, la réaction de type aldol se déroule via l'attaque nucléophile de l'énolate stabilisé par résonance sur le groupe carbonyle d'une autre molécule.
Par déshydratation de l'aldol, catalysée par la base, le produit final déshydraté est formé.
Comme dans le cas précédent, la déshydratation catalysée par une base (parfois écrite en une seule étape), permet de contrôler la réaction et de produire un produit final déshydraté. Dans certains cas, la formation d'énolates est irréversible.
Comme on le voit seule une quantité catalytique de base est nécessaire dans certains cas, la procédure la plus courante consiste à utiliser une quantité estequiométrica de base forte telle que LDA ou NaHMDS . Dans ce cas, la formation d'énolate est irréversible et le produit aldol n'est pas formé tant que l'alcoolate métallique du produit aldol n'est pas protoné dans une étape ultérieure.
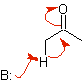
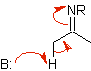
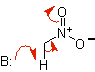
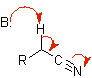
Équivalents synthétiques de divers énols et énolates
|
énolate |
azénolate |
énolate de nitroalcane |
énolate de nitrile |
|
|
|
|
|
|
ester, amide |
imine |
nitroalcane |
nitrile |
|
énol
|
éther d'énol |
ester d'énol |
Silyl énol éther |
énamine |
Alkylation des énols et énolates :
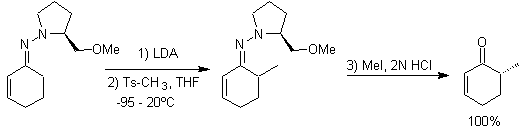
L'alkylation des énolates correspond le plus souvent à une réaction de substitution nucléophile avec des halogénures d'alkyle et des époxydes. Dans cette réaction, les halogénures d'alkyle primaire et de benzyle sont bons pour l'alkylation, les halogénures d'alkyle secondaire seulement dans certains cas, et les halogénures d'alkyle tertiaire ne réagissent fondamentalement pas avec les énolates, car la réaction se déroule par un mécanisme de substitution nucléophile.
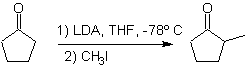
D'autre part, la vitesse de l'alkylation est augmentée par la polarité des solvants utilisés comme milieu réactionnel.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TORCHE |
|
NaHMDS |
|
DIPEA
|
|
|
|
|
|
|
|
Cy2BCl |
|
Bu 2 BOTF
|
|
|
Alkylation des silyl énol éthers , catalysée par les acides de Lewis. Alkylation O N 1


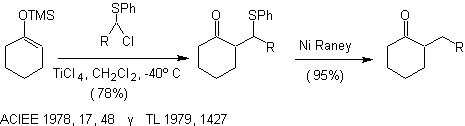
Alkylation d'énolates de composés a , b carbonyles insaturés :
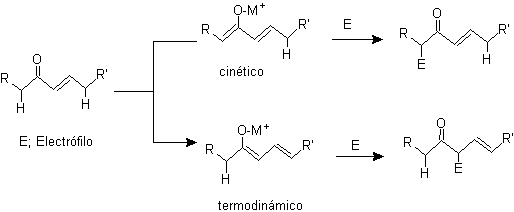
¨ g -alkylation de cétones insaturées en a , b
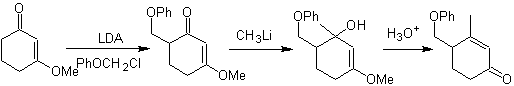
Alkylation des énamines .
La monolaquilation et la formation du produit cinétique sont contrôlées en profitant de l'effet stérique, pour lequel une amine secondaire volumineuse telle que la morpholine doit être utilisée.
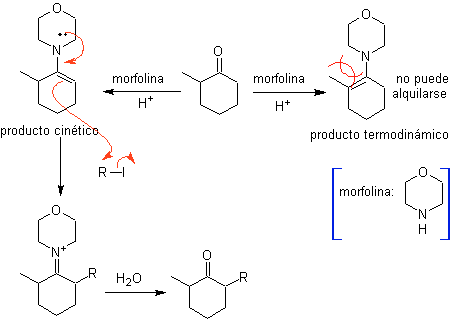
D'autre part, les énamines chirales , produisent en alkylation, également des cétones alpha substituées chirales
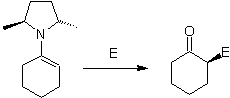
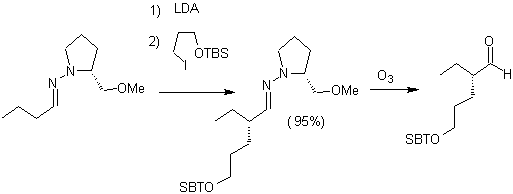
Alkyl imines : Les imines, qui sont isoélectroniques avec les cétones, peuvent être transformées en énamines, qui peuvent ensuite être alkylées ou mises à réagir avec un réactif. électrophile.
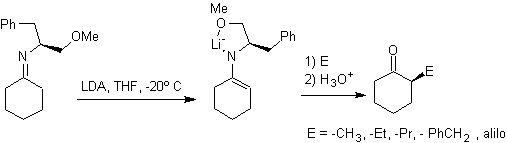
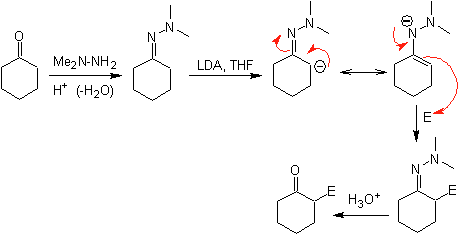
¨ Les anions hydrazone sont beaucoup plus réactifs que les énolates d'aldéhyde ou de cétone correspondants.
¨ Il y a un inconvénient, car il peut y avoir des difficultés dans l'hydrolyse finale.
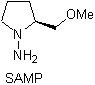
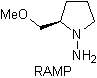
¨ Les hydrazones chirales sont utilisées pour l'alkylation asymétrique (les hydrazones RAMP/SAMP sont utilisées dans la synthèse asymétrique)
|
|
|
|