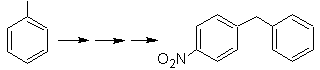SYNTHESE DES COMPOSES AROMATIQUES II
(Méthode de l'arbre de synthèse)
Bien qu'un des premiers problèmes à résoudre dans la synthèse des composés aromatiques multisubstitués soit le contrôle des effets d'orientation et de la formation d'isomères indésirables, il est également important d'étudier la réactivité des arènes, puisqu'à un moment donné de la sens de la présence de groupes aliphatiques dans le composé aromatique, à plusieurs reprises, ils présentent des caractéristiques et des réactivités, typiques du type de composé organique auquel ils appartiennent et celles particulières qui résultent de l'interaction mutuelle des groupes aliphatiques et aromatiques.
Dans ce but, il est basé, le synthèse des molécules n°20 à 27, cette fois à partir de matériaux spécifiés, la question est donc présentée comme suit : quelles sont les réactions qui Justifier les transformations suivantes ?
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
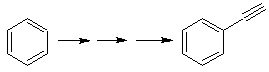
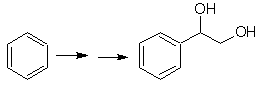
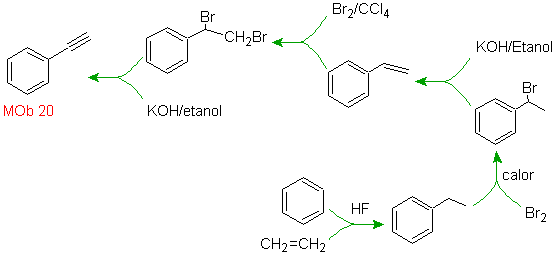
Solution Mob 20.
Nous savons qu'il n'y a aucune possibilité que l'ion acétylure agisse directement sur le benzène, donc la triple liaison est obtenue à partir d'un groupe alkyle vec-dibromé, qui est obtenu par bromation du styrène, précédemment obtenu par déshydrobromation d'un halogénure de benzyle formé par une bromation par voie radicalaire sur l'éthylbenzène
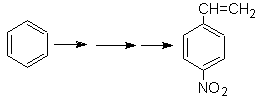
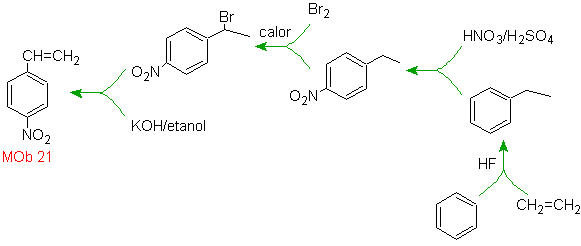
Solution Mob 21.
Le para nitrostyrène ne peut pas être obtenu par nitration directe du styrène, car le groupe éthényle attaché au cycle est instable dans les conditions de nitration.
Ainsi, la molécule précurseur aura un groupe facile à déshydrobromer. Ce précurseur est obtenu par bromation radicalaire du groupement éthyle lié au cycle benzénique, préalablement nitré principalement en position para.
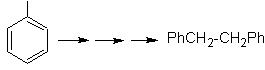
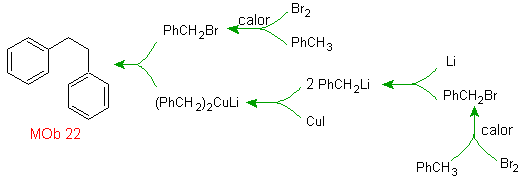
Solution MOb 22.
La symétrie de la molécule permet de penser à une stratégie prenant en compte la réaction de Corey-House. C'est aussi un bon itinéraire si vous utilisez le PhCH 2 CH 2 Cl, sur la benzène ou une acylation avec PhCH2COCl et la réduction subséquente du groupe carbonyle par réduction de Clemmensen sont prises en compte.
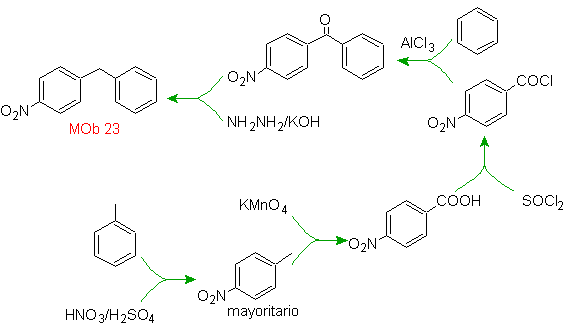
Solution de foule 23.
La molécule précurseur peut être une cétone dont le groupe carbonyle est réduit en méthylène par le réducteur de Wolf-Kischner. De cette façon, la présence de Zn en milieu acide qui affecterait le groupement nitro est évitée. Une autre molécule précurseur peut être l'halogénure suivant : O 2 N-PhCH 2 Cl qui agit sur une molécule de benzène.
La position brome dans la molécule précurseur est la position allylique typique, qui est obtenue par bromation radicalaire du squelette carboné correspondant.
Le groupe alkyle sur le cycle benzénique ne peut pas être obtenu à partir de halogénure correspondant, car la transposition se produirait. Ensuite, l'acylation et la réduction subséquente du groupe carbonyle sont utilisées, avec amalgamation du zinc en milieu acide (réduction de Clemmensen
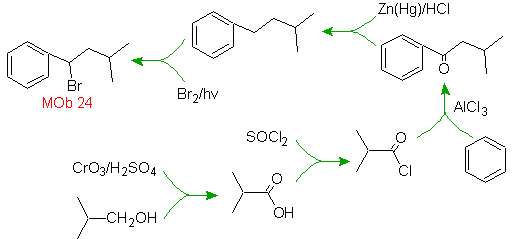
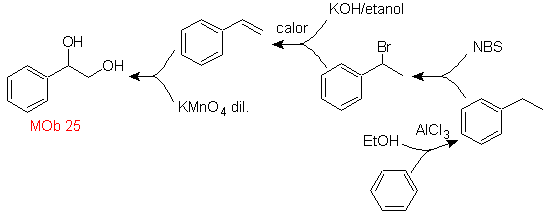
Solution MOb 25.
Le diol de cette molécule peut être obtenu par une hydroxylation sélective du styrène, comme molécule précurseur. Le styrène est formé à partir de la déshydrobromation, comme dans les cas précédents.
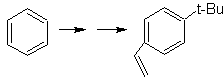
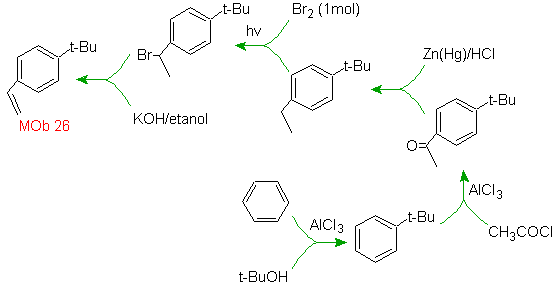
Solution MOb 26.
La molécule précurseur indique qu'une voie possible prend en compte la formation du groupe éthényle à partir d'un halogénure et profite du groupe volumineux du t-butyle, pour introduire le groupe acyle portant le groupe éthyle en position para.
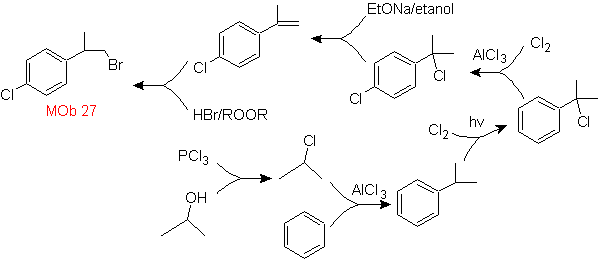
Solution de foule 27.
La stratégie consiste à définir l'inclusion du bromure dans une molécule précurseur qui ne permet la formation d'aucun isomère. L'alcène le moins substitué est celui qui est nécessairement formé par une déshydrohalogénation, à partir d'un groupe formé par halogénation de radicaux.
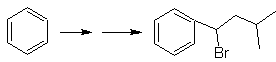
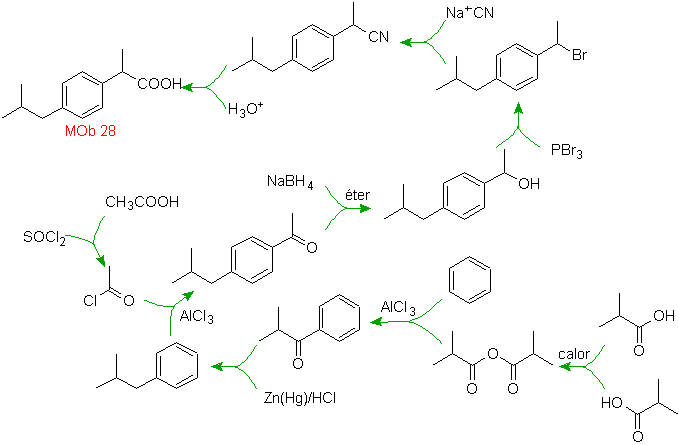
Solution MOb 28.
La localisation du groupe carboxylique permet de proposer sa formation à partir de l'hydrolyse du groupe -CN, ce dernier est introduit dans les molécules aliphatiques généralement par substitution d'un halogénure, lui-même issu d'un alcool. Formé par réduction d'une cétone carbonyle.
Les étapes suivantes sont liées à l'acylation de Friedel-Crafts, combinée à la réduction de C=O par la méthode de Clemmensen.
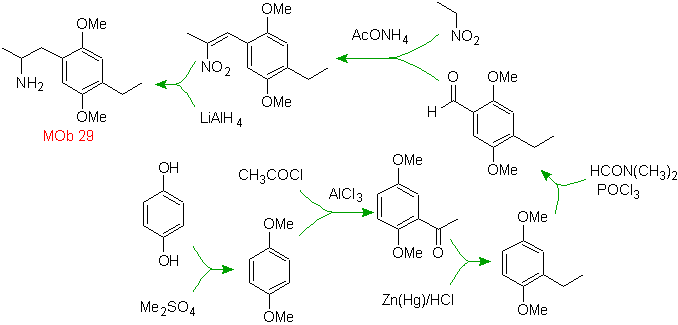
Solution MOb 29.
La présence du groupe amino dans le résidu alkyle de l'arène, nous fait penser au groupe nitro comme son précurseur et en raison de la distance du cycle benzénique, on peut proposer qu'il soit formé à partir du nitro - alpha-bêta insaturé , résultat d'une condensation de type aldol en milieu basique avec un groupe -CHO attaché au cycle benzénique. Ce groupe formyle est inséré dans le cycle par un formamide disubstitué et de l'oxychlorure de phosphore, connue sous le nom de réaction de Vilsmeier-Haack. Méthode applicable uniquement aux substrats aromatiques activés. Pour introduire le groupement éthyle par Friedel-Crafts Acylation, il est nécessaire de transformer au préalable les groupements -OH du matériau de départ en éther méthylique.