Oxydation Baeyer – Villiger
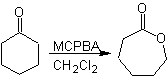
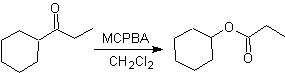
Une autre réaction qui peut être associée à la stratégie du La rétrosynthèse est l'oxydation des cétones par les peroxyacides, mieux connue sous le nom de réaction de Baeyer-Villiger. Dans les cétones cycliques, l'oxydation avec des peracides génère des lactones. Les groupes attachés aux cétones asymétriques ont une capacité migratoire, ce qui permet, au sens littéral, "d'insérer un atome d'oxygène" entre le groupe carbonyle et le groupe migrant, produisant ainsi un ester ou une lactone.
Il faut tenir compte du fait que les énones (cétones insaturées α, β) ne sont pas de bons substrats pour l'oxydation Baeyer-Villiger, car l'alcène est beaucoup plus réactif que la cétone. Cependant Il existe des structures particulières où l'alcène peut être protégé par un substituant proche du fait de l'effet stérique et ainsi diriger l'attaque du peracide vers le groupe carbonyle.
|
|
… |
|
Rappelons que l'aptitude migratoire des différents groupes, dans la réaction de Baeyer-Villiger, est la suivante :
H> Ph> 3º alkyle> cycloalkyle> 2º alkyle> 1º alkyle> Me
Proposer un plan de synthèse pour les molécules suivantes :
|
Mob 56
L-Dopa |
. |
Mob 57
|
. |
Mob 58
|
|
|
|
|
|
|
|
Mob 59
|
|
Mob 60
|
|
foule 61
|
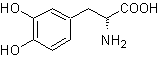
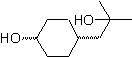
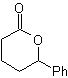
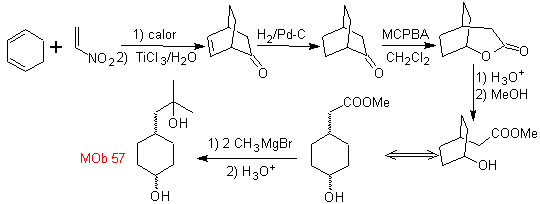
Mob 56. Analyse rétrosynthétique. L'acide alpha aminé
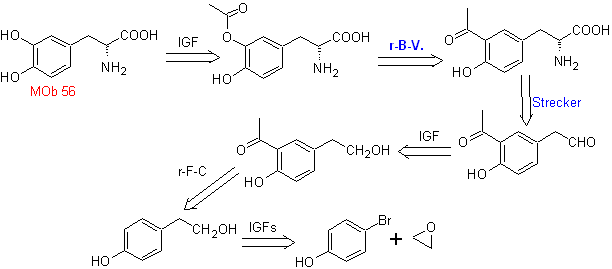
La synthèse. Pour Pour la formation du Grignard recherché, l'ortho OH du benzène est protégé. La synthèse de Strecker permet la formation de l'acide alpha aminé, qui est oxydé selon Baeyer-Villiger avec un peracide et le produit subit une hydrolyse acide du groupe ester, ce qui conduit à la formation de
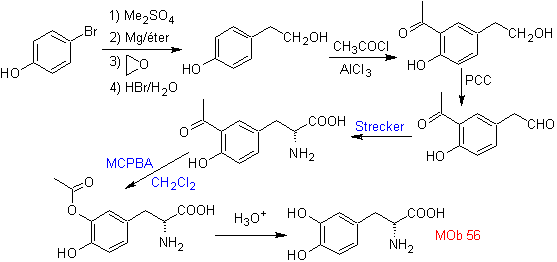
MOb 57
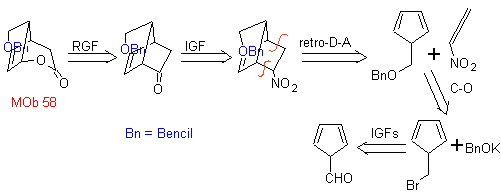
. Rétro
analyse
synthétique
.
_
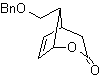
Ce MOb est un alcool tertiaire, il peut donc être préparé à partir d'un ester et d'un excès de Grignard.La molécule précurseur formée est un composé 1,6-diCO, on a donc recours à sa reconnexion en une lactone, qui peut être formée à partir de une cétone. Cette cétone bicyclique est fonctionnalisée avec un point d'insaturation pour obtenir une structure d'adduit de Diels-Alder. Le groupe carbonyle peut être formé à partir d'un composé contenant un groupe nitro, par la réaction Nef
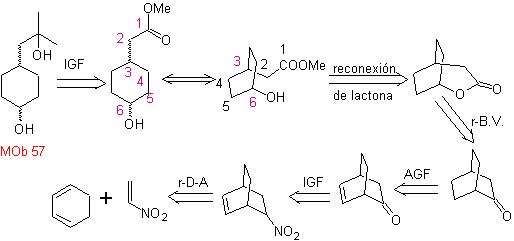
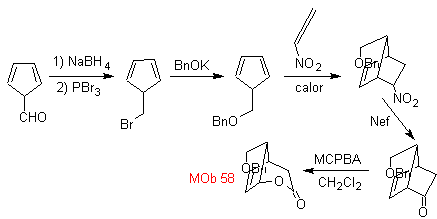
synthèse . Il part de la réaction de Diels-Alder d'un cyclohexadiène et d'un nitroéthylène. L'adduit formé est saturé, pour procéder à l'oxydation Baeyer-Villiger. L'ouverture de la lactone et l'estérification du groupement acide, forment un intermédiaire qui est ensuite traité avec un excès de bromure de méthylmagnésium, pour obtenir
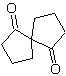
Mob 58. Analyse rétrosynthétique. La double liaison conjuguée à un groupe C=O, présent dans
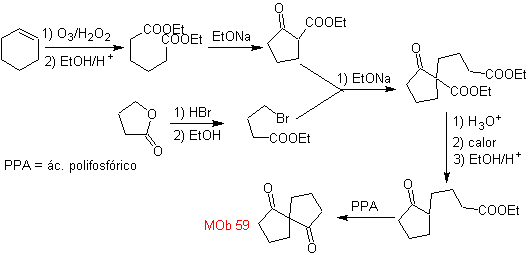
MOb 59 . Analyse rétrosynthétique. Il procède à la déconnexion
Une fois de plus, un 1,3-diCO intermédiaire ou précurseur est généré, qui, lorsqu'il est déconnecté, génère une nouvelle structure 1,6-diCO, qui peut maintenant être reconnectée pour atteindre le cyclohexène comme matériau de départ.
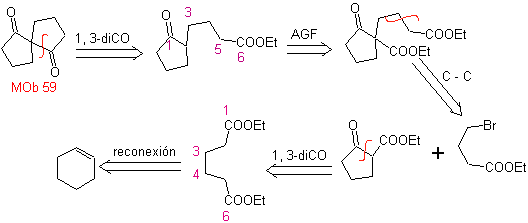
synthèse . L'ouverture oxydative d'un cyclohexène permet d'obtenir la molécule précurseur qui, après réaction avec le γ-bromoester, donne naissance à une molécule qui, après une réaction de Dieckmann, se transforme facilement en
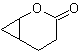
Mob 60 . Analyse rétrosynthétique. On suppose que la formation de
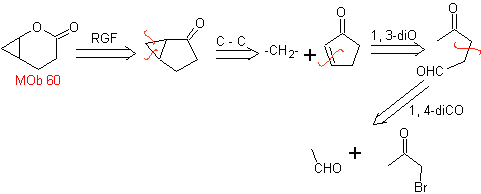
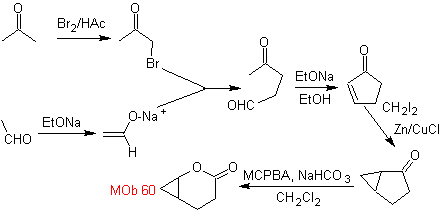
synthèse . L'énolate d'acétaldéhyde se combine avec l'α-bromocétone pour former une molécule de 1,4-diCO, qui dans un milieu basique et EtOH se condense avec déshydratation pour former une cyclopentanone α,β-insaturée. La réaction de Simonns-Schmidt se poursuit forment du cyclopropane et une oxydation ultérieure de celui-ci selon Baeyer-Villiger produit
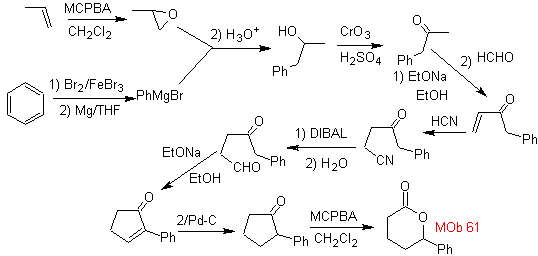
Mob 61 . Analyse rétrosynthétique . Il est entendu que
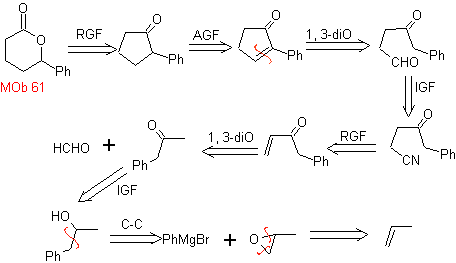
La synthèse. Le propène et le benzène sont pris comme matières premières, la stratégie consiste à réduire le nitrile en CHO avec DIBAL dans l'hexane, pour former l'intermédiaire qui, par annulation Robinson (ou annulation) et saturation ultérieure, fournit la cyclopentanone adéquate à oxyder par le Baeyer- Procédure Villiger, pour former