COUPURE DE COMPOSÉS DE 1,4-DIOXYGÈNE
Un autre groupe de composés de grande importance en synthèse chimique est constitué de molécules dioxygénées qui se retrouvent dans un rapport de distance de 1,4. Ces composés, lorsqu'ils sont soumis à une analyse de déconnexion rétrosynthétique, génèrent des synthons, dont l'un, l'électrophile ou le nucléophile, peut être considéré comme "anormal" ou "illogique", car la charge attribuée à l'un des atomes ne s'explique pas par termes de son électronégativité intrinsèque ou induite.
1. Composés 1,4-dioxygène (1,4-diO)
Dans ce type de composés, la déconnexion conduit également à un synthon logique et à un autre synthon illogique (non naturel), qui peut être un nucléophile ou un électrophile, dont l'équivalent synthétique doit encore être adéquatement retravaillé, afin d'être utilisé dans la réaction chimie.
1. 1. Composés 1,4-dicarbonyle
1.1.1. Composés de 1,4-dicétone
Les alternatives de déconnexion de ce type de composés ou molécules à synthétiser (MOb), peuvent conduire aux options suivantes :
pour. Un synthon anionique logique et un synthon cationique illogique
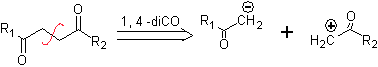
L'équivalent synthétique de l'anion est l'ion énolate ou l'énol lui-même du composé carbonyle. Au lieu de cela, l'équivalent synthétique du carbocation est l'alpha halocarbonyle. (Umpoloung)
b. Un synthon cationique logique et un synthon anionique illogique
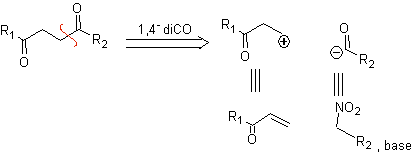
L'équivalent synthétique du synthon cationique logique est le composé carbonyle α,β-insaturé. Un équivalent synthétique approprié pour l'anion synthon peut être un anion nitroalcane. Le groupement –NO 2 des alcanes peut être transformé en C=O, par la réaction de Nef, ou par les variantes de la réaction de McMurry, où par action de TiCl 3, le nitroalcane est transformé en une imine, qui est alors It est hydrolysé en milieu acide en le composé carbonylé respectif.
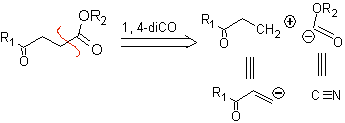
1.1.2. Composés 1,4-cétoester
Les γ-cétoesters, les 1,4-diesters et les 1,4-diacides peuvent être déconnectés d'un synthon cationique naturel, dont l'équivalent synthétique est un composé carbonylé α,β-insaturé, et du non-naturel («illogique» ) anion synthon.(-) COOR, dont l'équivalent synthétique est l'ion cyanure.
Exemples : Proposer un design de synthèse, à partir de matériaux simples et abordables, pour chacune des molécules suivantes :
|
Mob 35
|
|
Mob 36
|
|
|
|
|
|
Mob 37
|
|
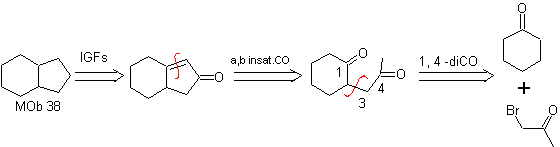
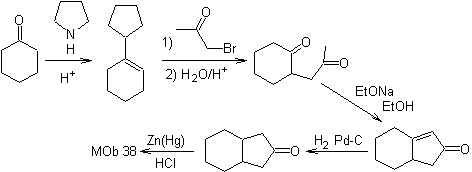
Mob 38
|
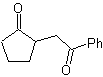
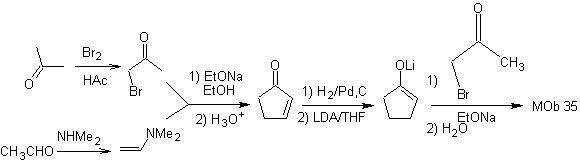
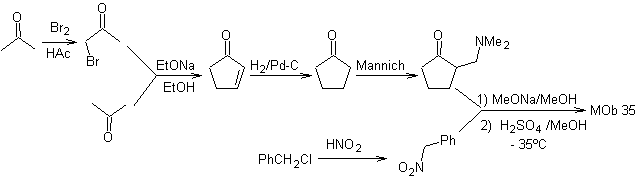
MOb 35 (a). Analyse rétrosynthétique . La molécule peut être déconnectée selon le modèle 1,4-diCO. Le précurseur généré cyclopentanone doit être préalablement activé pour que son Cα soit plus nucléophile, puis être utilisé dans la réaction avec l'α.bromoacétone.
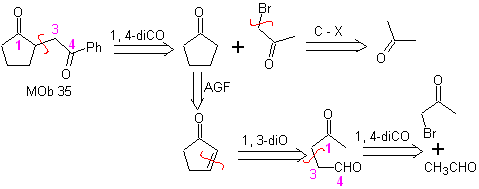 synthèse . La nucléophilie de la cyclopentanone est contrôlée et garantie, à l'aide de LDA, pour arriver à
synthèse . La nucléophilie de la cyclopentanone est contrôlée et garantie, à l'aide de LDA, pour arriver à
MOb 35 (b). Analyse rétrosynthétique . Le modèle 1,4-diCO qui présente
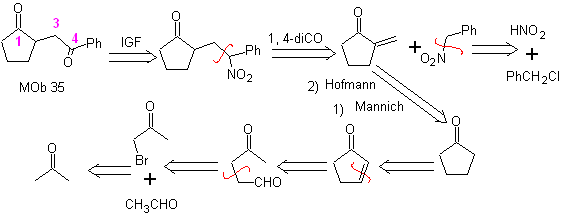
synthèse . De même, la dernière étape, pour atteindre
L'utilisation de nitroalcanes secondaires ou de nitroarènes génère des cétones en tant que produit, par la réaction Nef, c'est pourquoi cette méthodologie n'est applicable qu'aux composés 1,4-cétoesters, 1,4-cétones et 1,4-cétoaldéhydes.
MOb 36. Analyse rétrosynthétique. Dans le premier cas, le groupe carboxylique de
Il faut comprendre que la double liaison dans le cycle est plus réactive à l'époxydation que l'autre double liaison. La déconnexion ultérieure α,β-insat CO, permet de former une structure plus facile à déconnecter par les modèles les dioxygénats générés dans les molécules intermédiaires.
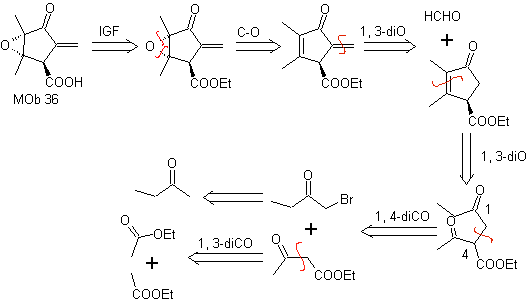
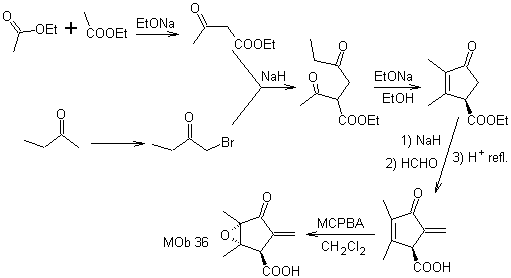
La synthèse. Le seul soin qu'il faut apporter à cette synthèse est l'époxydation de la double liaison cyclique, plus réactive que la double liaison vinylique, puis les réactions pour aboutir à la synthèse de
MOb 37. Analyse rétrosynthétique : La déconnexion de
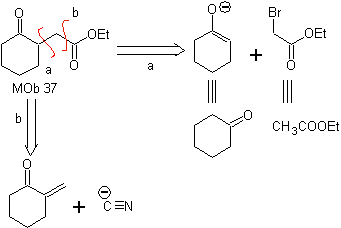
Synthèse : La déconnexion (a) suit. hydrolyse à la fin, il doit être contrôlé, pour n'affecte pas la groupe ester de MOb 37
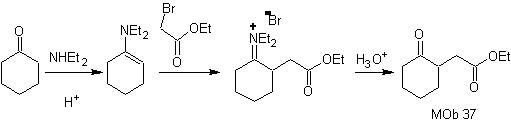
synthèse . L'énamine de la cyclohexanone est à nouveau utilisée pour déplacer l'halogène de la cétone. Le composé 1,4-diCO formé est cyclisé en milieu basique.
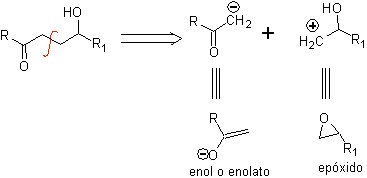
2.1.2. g -Composés hydroxycarbonylés
Un composé γ-hydroxycarbonyle correspond au modèle 1,4-diO, c'est pourquoi sa déconnexion fournit un synthon anionique logique et un synthon cationique illogique, dont l'équivalent synthétique peut être un époxyde.
|
Comment la molécule suivante a-t-elle pu être synthétisée ?
|
Mob 39
|
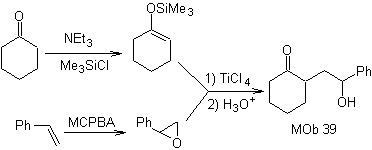
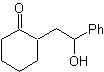
MOb 39. Analyse rétrosynthétique. La déconnexion du modèle Le γ-hydroxycarbonyle, MOb 39, donne naissance à la cyclohexanone comme molécule précurseur et à un époxyde aromatique. Il faut chercher l'énol ou l'énolate de la cétone, qui active son Cα, pour ouvrir l'époxyde du côté le moins encombré.
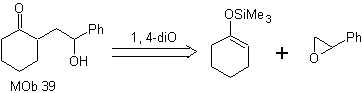
La synthèse. L'éther de silylène est un nucléophile puissant, capable d'attaquer un époxyde du côté le moins protégé, en milieu acide et catalysé par le sel de Ti(IV).