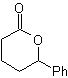
Oksidasi Baeyer–Villiger
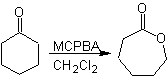
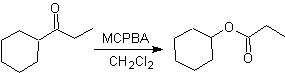
Reaksi lain yang dapat dikaitkan dengan strategi Retrosintesis adalah oksidasi keton oleh asam peroksi, lebih dikenal sebagai reaksi Baeyer-Villiger. Dalam keton siklik, oksidasi dengan peracid menghasilkan lakton. Gugus yang melekat pada keton asimetris memiliki kemampuan migrasi, yang memungkinkan, secara literal, untuk "memasukkan atom oksigen" antara gugus karbonil dan gugus migrasi, sehingga menghasilkan ester atau lakton.
Perlu diperhatikan bahwa enon (α, β tak jenuh keton) bukanlah substrat yang baik untuk oksidasi Baeyer-Villiger, karena alkena jauh lebih reaktif daripada keton. Namun Ada struktur khusus di mana alkena dapat dilindungi oleh substituen terdekat karena efek sterik dan dengan demikian mengarahkan serangan peracid ke arah gugus karbonil.
| … |
|
Ingatlah bahwa kemampuan migrasi dari berbagai kelompok, dalam reaksi Baeyer-Villiger, adalah sebagai berikut:
H> Ph> 3º alkil> sikloalkil> 2º alkil> 1º alkil> Me
Usulkan rencana sintesis untuk molekul-molekul berikut:
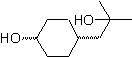
MO 56
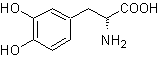
L-Dopa | . | MO 57
| . | MO 58
|
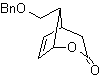
MO 59
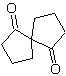
| MO 60
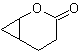
| massa 61
|
MO 56. Analisis retrosintetik.
Asam alfa amino
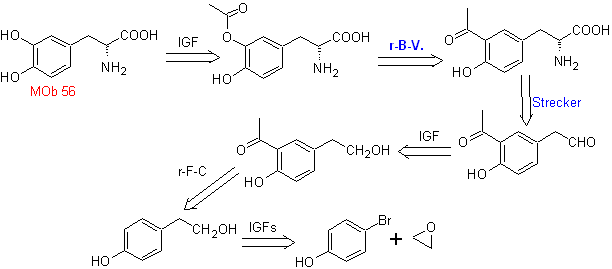
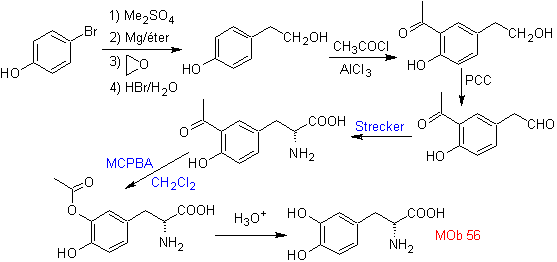
Perpaduan. Untuk Untuk pembentukan Grignard yang diperlukan, orto OH dari benzena dilindungi. Sintesis Strecker memungkinkan pembentukan asam amino alfa, yang dioksidasi menurut Baeyer-Villiger dengan peracid dan produk mengalami hidrolisis asam dari gugus ester, yang mengarah pada pembentukan
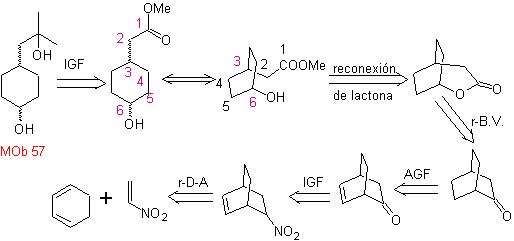
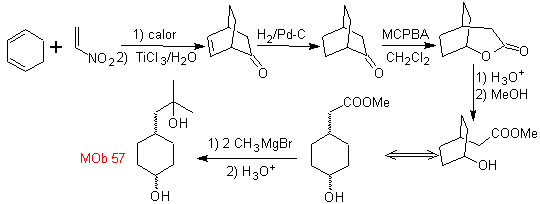
sintesis . Dimulai dari reaksi Diels-Alder dari cyclohexadiene dan nitroethylene. Hasil adukan yang terbentuk dijenuhkan, untuk dilanjutkan ke oksidasi Baeyer-Villiger. Pembukaan lakton dan esterifikasi gugus asam, membentuk zat antara yang kemudian direaksikan dengan metil magnesium bromida berlebih, untuk memperoleh
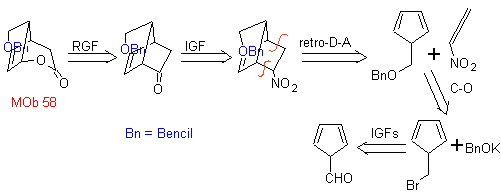
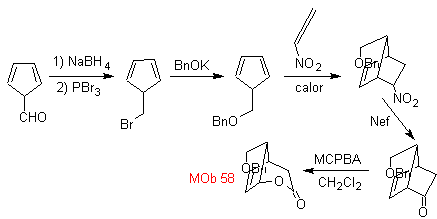
MO 58. Analisis retrosintetik. Ikatan rangkap terkonjugasi ke gugus C=O, terdapat pada
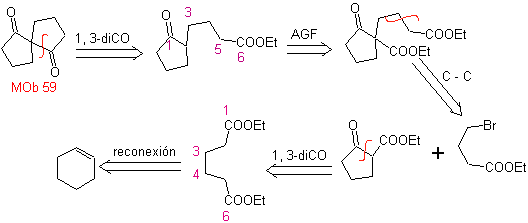
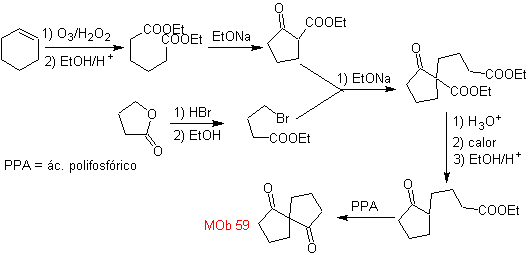
MOb 59 . Analisis retrosintetik. Ini hasil untuk memutuskan
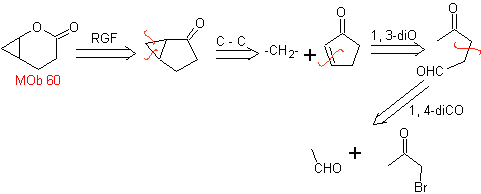
Sekali lagi, intermediet atau prekursor 1,3-diCO dihasilkan, yang ketika dilepas, menghasilkan struktur 1,6-diCO baru, yang sekarang dapat dihubungkan kembali untuk mencapai sikloheksena sebagai bahan awal.
sintesis . Pembukaan oksidatif sikloheksena memungkinkan diperolehnya molekul prekursor yang, setelah bereaksi dengan γ-bromoester, menghasilkan molekul yang, setelah reaksi Dieckmann, mudah diubah menjadi
MOb 60 . Analisis retrosintetik. Diasumsikan bahwa pembentukan
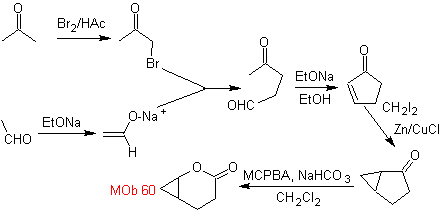
sintesis . Enolat asetaldehida bergabung dengan α-bromoketon untuk membentuk molekul 1,4-diCO, yang dalam media dasar dan EtOH mengembun dengan dehidrasi untuk membentuk siklopentanon tak jenuh α,β. Reaksi Simonns-Schmidt dilanjutkan membentuk siklopropana dan oksidasi selanjutnya sesuai dengan produksi Baeyer-Villiger
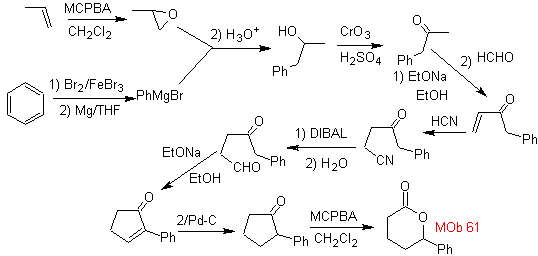
MOb 61 . Analisis retrosintetik . Ini diasumsikan bahwa
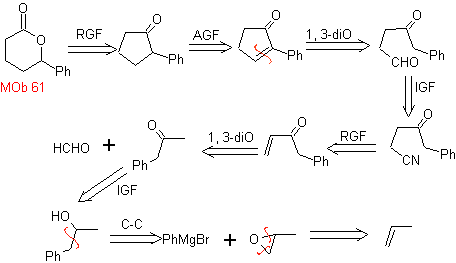
Perpaduan. Propena dan benzena diambil sebagai bahan awal, strateginya adalah mereduksi nitril menjadi C H O dengan DIBAL dalam heksana, untuk membentuk zat antara yang dengan annulasi Robinson (atau annulasi) dan saturasi berikutnya, menyediakan siklopentanon yang memadai untuk dioksidasi oleh Baeyer- Prosedur Villiger, untuk membentuk