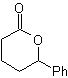
Baeyer-Villiger-Oxidation
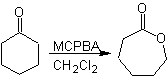
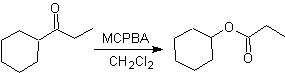
Eine weitere Reaktion, die mit der Strategie der verbunden werden kann Retrosynthese ist die Oxidation von Ketonen durch Peroxysäuren, besser bekannt als Baeyer-Villiger-Reaktion. In zyklischen Ketonen erzeugt die Oxidation mit Persäuren Lactone. Die an die asymmetrischen Ketone gebundenen Gruppen haben eine Migrationsfähigkeit, die es buchstäblich ermöglicht, "ein Sauerstoffatom zwischen die Carbonylgruppe und die wandernde Gruppe einzufügen", wodurch ein Ester oder ein Lacton erzeugt wird.
Dabei ist zu berücksichtigen, dass Enone (α,β-ungesättigte Ketone) keine guten Substrate für die Baeyer-Villiger-Oxidation sind, da das Alken viel reaktiver ist als das Keton. Jedoch Es gibt spezielle Strukturen, bei denen das Alken aufgrund des sterischen Effekts durch einen nahegelegenen Substituenten geschützt werden kann und so den Angriff der Persäure auf die Carbonylgruppe lenkt.
| … |
|
Denken Sie daran, dass die Migrationsfähigkeit der verschiedenen Gruppen in der Baeyer-Villiger-Reaktion wie folgt ist:
H> Ph> 3º Alkyl> Cycloalkyl> 2º Alkyl> 1º Alkyl> Me
Schlagen Sie einen Syntheseplan für die folgenden Moleküle vor:
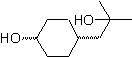
MB 56
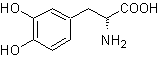
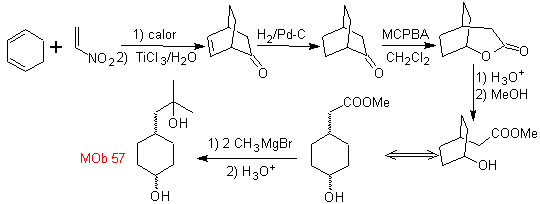
L-Dopa | . | MB 57
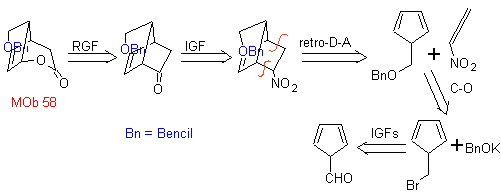
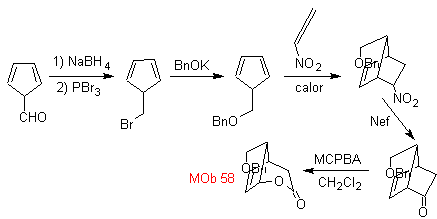
| . | MB 58
|
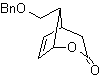
MB 59
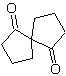
| MB 60
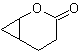
| Mob 61
|
MB 56. Retrosynthetische Analyse.
Die Alpha-Aminosäure
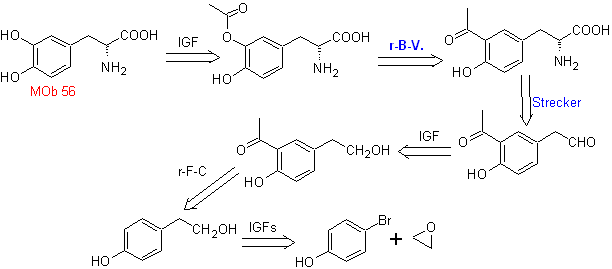
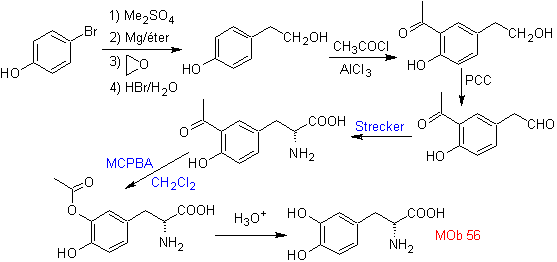
Synthese. Für Für die Bildung des benötigten Grignards wird das ortho-OH des Benzols geschützt. Die Strecker-Synthese ermöglicht die Bildung der alpha-Aminosäure, die nach Baeyer-Villiger mit einer Persäure oxidiert wird und das Produkt einer sauren Hydrolyse der Estergruppe unterliegt, die zur Bildung von führt
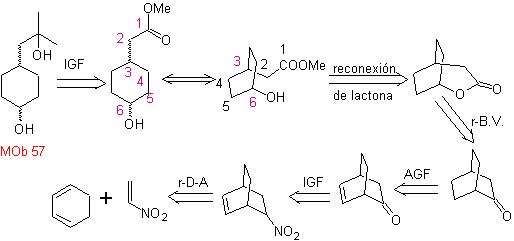
Synthese . Es geht von der Diels-Alder-Reaktion eines Cyclohexadiens und eines Nitroethylens aus. Das gebildete Addukt wird gesättigt, um zur Baeyer-Villiger-Oxidation überzugehen. Die Öffnung des Lactons und die Veresterung der Säuregruppe bildet ein Zwischenprodukt, das dann mit einem Überschuss an Methylmagnesiumbromid behandelt wird, um es zu erhalten
MB 58. Retrosynthetische Analyse. Die Doppelbindung konjugiert mit einer C=O-Gruppe, vorhanden in
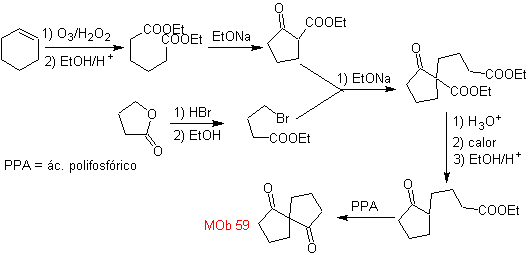
MOB 59 . Retrosynthetische Analyse. Es fährt fort, die Verbindung zu trennen
Wiederum wird ein Zwischenprodukt oder Vorläufer 1,3-diCO erzeugt, der, wenn er getrennt wird, eine neue 1,6-diCO-Struktur erzeugt, die nun wieder verbunden werden kann, um Cyclohexen als Ausgangsmaterial zu erreichen.
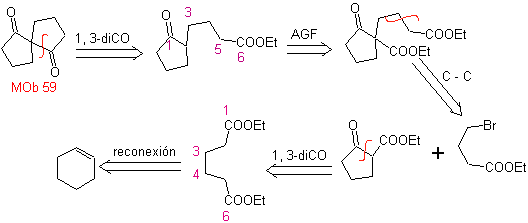
Synthese . Die oxidative Öffnung eines Cyclohexens ermöglicht den Erhalt des Vorläufermoleküls, das nach Reaktion mit dem γ-Bromester zu einem Molekül führt, das nach einer Dieckmann-Reaktion leicht umgewandelt werden kann
MB 60 . Retrosynthetische Analyse. Es wird angenommen, dass die Bildung von
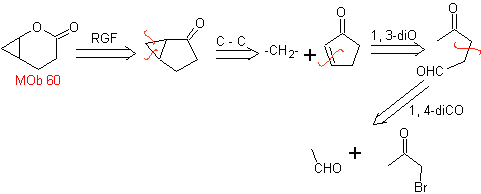
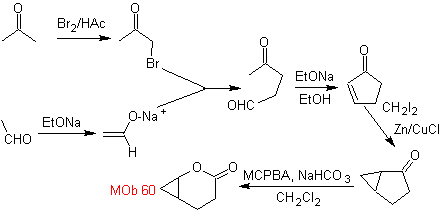
Synthese . Das Acetaldehydenolat verbindet sich mit α-Bromketon zu einem 1,4-diCO-Molekül, das in basischem Medium und EtOH unter Dehydratisierung zu einem α,β-ungesättigten Cyclopentanon kondensiert. Die Simonns-Schmidt-Reaktion wird fortgesetzt Cyclopropan bilden und eine anschließende Oxidation davon nach Baeyer-Villiger erzeugt
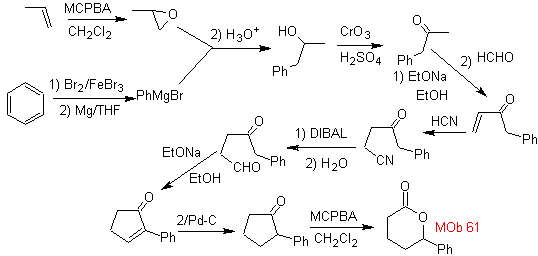
MB 61 . Retrosynthetische Analyse . Es wird angenommen dass
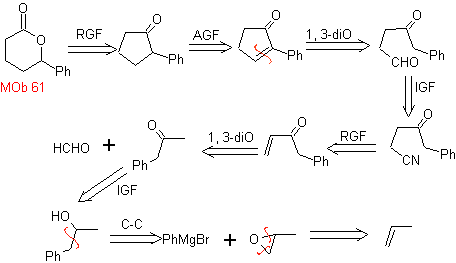
Synthese. Propen und Benzol werden als Ausgangsmaterialien verwendet, die Strategie besteht darin, das Nitril mit DIBAL in Hexan zu CHO zu reduzieren, um das Zwischenprodukt zu bilden, das durch Robinson-Anellierung (oder Anellierung) und anschließende Sättigung das geeignete Cyclopentanon liefert, das durch die Baeyer- Villiger-Verfahren, zu bilden