A) Heterocycles dengan 6 atom dan 6 p elektron.
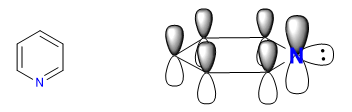
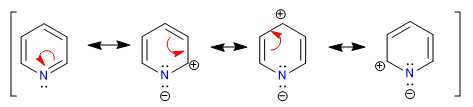
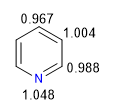
Nitrogen yang lebih elektronegatif menarik awan elektron ke arahnya, meninggalkan karbon yang kekurangan elektron. Oleh karena itu, sistem ini dianggap kekurangan pi sehubungan dengan benzena. Pada gambar berikut saya mewakili kerapatan muatan rata-rata yang didukung oleh setiap karbon, dalam benzena semua karbon akan mendukung kerapatan 1.
Keelektronegatifan nitrogen menyebabkan retensi awan elektronik di atasnya, menurunkan aromatisitas sistem, serta kemampuannya untuk menyerang elektrofil. Namun, reaksi yang dilanjutkan dengan serangan nukleofil pada cincin lebih disukai.
Delapan jenis senyawa aza yang berasal dari benzena diketahui:
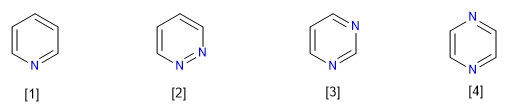
[1] Piridin
[2] Piridazin
[3] pirimidin
[4] Pirazina
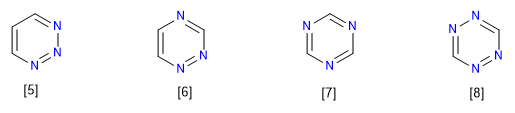
[5] 1,2,3-Triazin
[6] 1,2,4-Triazin
[7] 1,3,5-Triazin
[8] 1,2,3,5-Tetrazin
Heterocycles lain milik keluarga ini dengan heteroatom selain nitrogen adalah:
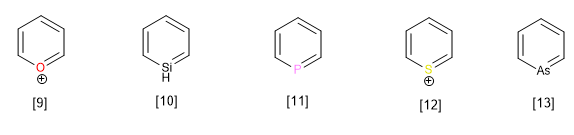
[9] Kation pirillium
[10] Silabenzena
[11] Fosfabenzena
[12] Kation tiopirilium
[13] Arsabenzena
B) Heterocycles dari 5 atom dan 6 elektron pi.
Mereka adalah senyawa dengan kelebihan elektronik atau p -surplus. Karbon memiliki kerapatan muatan yang lebih tinggi daripada benzena, hal ini membuatnya sangat reaktif terhadap elektrofil tetapi secara drastis menurunkan reaktivitasnya terhadap nukleofil. Anggota khas dari keluarga ini adalah pirol.
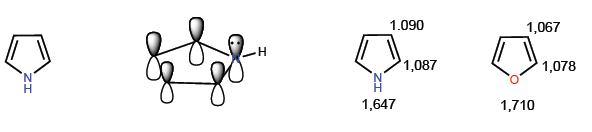
Anggota paling representatif dari keluarga heterocycles ini adalah:
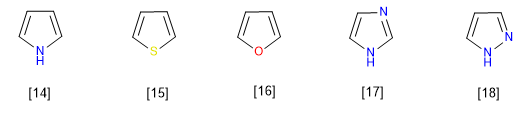
[14] Pirole
[15] Tiofena
[16] Furan
[17] Imidazol
[18] pirazol
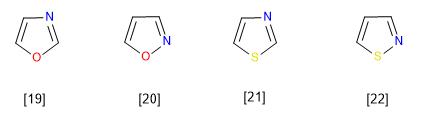
[19] Oksazol
[20] Isoksazol
[21] Tiazol
[22] Isothiazol
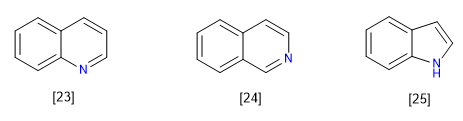
C) Sistem kental atau menyatu