A) Heterocyclen mit 6 Atomen und 6 p -Elektronen.
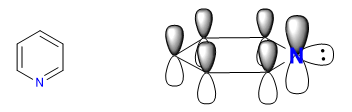
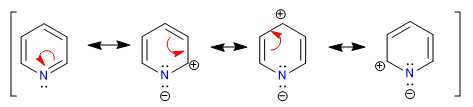
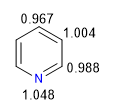
Der elektronegativere Stickstoff zieht die Elektronenwolke an und lässt die elektronenarmen Kohlenstoffe zurück. Daher wird dieses System in Bezug auf Benzol als pi-defizient angesehen. Im folgenden Bild stelle ich die durchschnittliche Ladungsdichte dar, die jeder Kohlenstoff unterstützt, in einem Benzol würden alle Kohlenstoffe eine Dichte von 1 unterstützen.
Die Elektronegativität von Stickstoff bewirkt, dass die elektronische Wolke darauf zurückgehalten wird, wodurch die Aromatizität des Systems sowie seine Fähigkeit, Elektrophile anzugreifen, verringert werden. Begünstigt sind jedoch Reaktionen, die unter nukleophilem Angriff auf den Ring ablaufen.
Acht Arten von Azaverbindungen, die sich von Benzol ableiten, sind bekannt:
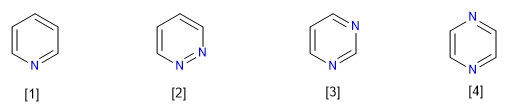
[1] Pyridin
[2] Pyridazin
[3] Pyrimidin
[4] Pyrazin
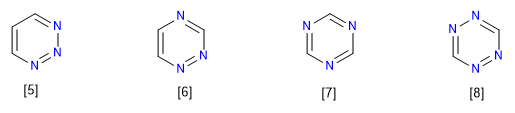
[5] 1,2,3-Triazin
[6] 1,2,4-Triazin
[7] 1,3,5-Triazin
[8] 1,2,3,5-Tetrazin
Andere zu dieser Familie gehörende Heterocyclen mit einem anderen Heteroatom als Stickstoff sind:
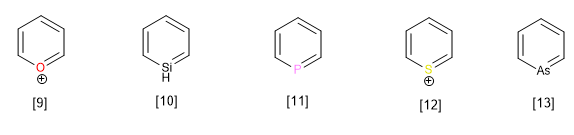
[9] Pyrylliumkation
[10] Silabenzol
[11] Phosphabenzol
[12] Thiopyrilium-Kation
[13] Arsabenzol
B) Heterocyclen aus 5 Atomen und 6 Pi-Elektronen.
Sie sind Verbindungen mit elektronischem Überschuss oder p -Überschuss. Kohlenstoffe haben eine höhere Ladungsdichte als Benzol, was sie sehr reaktiv gegenüber Elektrophilen macht, aber ihre Reaktivität gegenüber Nucleophilen drastisch verringert. Ein typisches Mitglied dieser Familie ist Pyrrol.
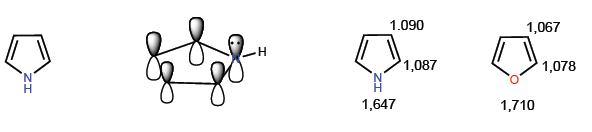
Die repräsentativsten Mitglieder dieser Familie von Heterocyclen sind:
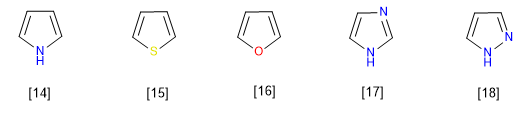
[14] Pyrrol
[15] Thiophen
[16] Furan
[17] Imidazol
[18] Pyrazol
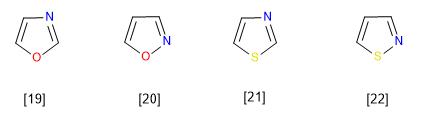
[19] Oxazol
[20] Isoxazol
[21] Thiazol
[22] Isothiazol
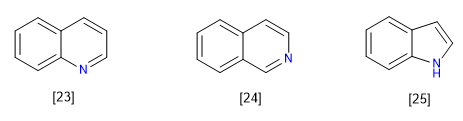
C) Kondensierte oder verschmolzene Systeme